题目内容
18.硫酸亚铁铵晶体(FeSO4•(NH4)2SO4•xH2O)俗称莫尔盐.某化学兴趣小组用废铁屑为原料制备莫尔盐,并探究其性质.资料:废铁屑中含有FeS等杂志,FeSO4的溶解度曲线如图1所示.
实验一 制备莫尔盐
莫尔盐的制备流程如图2.
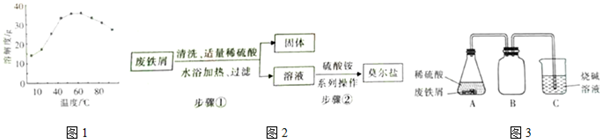
(1)步骤①利用图3装置制备硫酸亚铁溶液,B装置的作用是防止倒吸.
(2)步骤①中过滤时,要趁热进行的原因是FeSO4在温度低时溶解度较小,如果不趁热过滤就会有FeSO4•7H2O析出.
(3)步骤②利用溶解度差异制取莫尔盐,操作顺序是b→c→a→d.
a.过滤b.加热浓缩c.冷却结晶d.洗涤干燥
实验二 测定莫尔盐(FeSO4•(NH4)2SO4•xH2O)的组成
取2分7.84g的莫尔盐,分别进行实验:一份配成250mL溶液,取25.00mL用0.020mol•L-1的酸性KMnO4标准溶液滴定,到达滴定终点是,消耗标准溶液20.00mL;另一份莫尔盐保持200℃加热至恒重,称重为5.68g.(已知:莫尔盐在200℃以下仅失去结晶水)
(4)滴定反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
(5)用酸性高锰酸钾溶液滴定,判断终点的现象为滴入最后一滴高锰酸钾溶液,溶液呈紫红色且半分钟不变.
(6)x=6.
实验三 探究莫尔盐的抗氧化能力
(7)将滴有KSCN的莫尔盐溶液暴露在空气中,放置一段时间后,溶液会逐渐变红.请设计简单实验证明莫尔盐溶液比硫酸亚铁溶液抗氧化能力更强.
答:分别取相同体积、相同浓度的莫尔盐溶液和硫酸亚铁溶液于两支试管中,滴入KSCN溶液,再滴入氯水,观察溶液变红色的快慢判断.
分析 (1)B装置是安全瓶防止氢氧化钠溶液倒吸;
(2)硫酸亚铁铵的溶解度小;
(3)利用溶解度差异制取莫尔盐,应是冷却热饱和溶液的方法,加热浓缩,冷却结晶,过滤洗涤,干燥得到溶质晶体;
(4)滴定实验是高锰酸钾溶液滴定亚铁离子反应生成铁离子、锰离子和水,结合电荷守恒配平书写离子方程式;
(5)高锰酸钾本身有颜色,滴定亚铁离子不需要指示剂,当滴加最后一滴溶液后,溶液变成紫红色,30S内不褪色,说明达到滴定终点;
(6)依据高锰酸钾和亚铁离子反应计算亚铁离子物质的量,得到250ml溶液中亚铁离子物质的量,化学式可知,莫尔盐物质的量和亚铁离子物质的量相同,结合受热分解固体质量减小的为结晶水的质量,计算物质的量,得到x;
(7)分别取相同体积、相同浓度的莫尔盐溶液和硫酸亚铁溶液于两支试管中,滴入KSCN溶液,再滴入氯水,观察溶液变红色的快慢判断.
解答 解:(1)废铁屑中含有FeS,与稀硫酸反应生成硫化氢气体和氢气,硫化氢气体被氢氧化钠吸收,为防止溶液倒吸,B装置起到防止倒吸的主要作用,
故答案为:防倒吸;
(2)步骤①中过滤时,要趁热进行的原因是,如果不趁热过滤就会有FeSO4•7H2O析出,
故答案为:FeSO4在温度低时溶解度较小,如果不趁热过滤就会有FeSO4•7H2O析出;
(3)利用溶解度差异制取莫尔盐,通过加热浓缩,冷却结晶,过滤洗涤,干燥得到溶质晶体,操作顺序是bcad,
故答案为:bcad;
(4)滴定反应的离子方程式5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
(5)高锰酸钾本身有颜色,滴定亚铁离子不需要指示剂,当滴加最后一滴溶液后,溶液变成紫红色,30S内不褪色,说明达到滴定终点,故答案为:加入最后一滴KMnO4溶液紫红色不褪,且半分钟内不褪色;
(6)反应5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,配成250mL溶液,取25.00mL用0.020mol•L-1的酸性KMnO4标准溶液滴定,到达滴定终点是,消耗标准溶液20.00mL
5Fe2+~MnO4-,
5 1
n(Fe) 0.02mol/L×0.02L
n(Fe)=0.002mol
250ml溶液中含亚铁离子0.02mol,(NH4)2SO4•FeSO4•xH2O为0.02mol,
保持200℃加热至恒重,称重为5.68g.失去结晶水质量=7.84g-5.68g=2.16g
n(H2O)=$\frac{2.16g}{18g/mol}$=0.12mol
据硫酸亚铁铵的化学式为(NH4)2SO4•FeSO4•xH2O,根据原子守恒,得到x=6,
故答案为:6;
(7)分别取相同体积、相同浓度的莫尔盐溶液和硫酸亚铁溶液于两支试管中,滴入KSCN溶液,再滴入氯水,观察溶液变红色的快慢判断,莫尔盐溶液出现红色的时间晚,说明莫尔盐溶液比硫酸亚铁溶液抗氧化能力更强,
故答案为:分别取相同体积、相同浓度的莫尔盐溶液和硫酸亚铁溶液于两支试管中,滴入KSCN溶液,再滴入氯水,观察溶液变红色的快慢判断.
点评 本题考查制备实验方案的设计,综合性较强,注意晶体析出时含结晶水的计算方法,实验分析和设计的分析应用,难度较大.

 小学期末标准试卷系列答案
小学期末标准试卷系列答案| A. | 原子半径由大到小的顺序是:C>B>A | |
| B. | AxBy中A的化合价不可能为+1价 | |
| C. | C与B形成的化合物溶于水都能得到单质B | |
| D. | A、B两元素的气态氢化物可以相互反应 |
| A. | v(A)=0.01 mol/(L•s) | B. | v(B)=0.02 mol/(L•s) | C. | v(B)=0.60mol/(L•s) | D. | v(C)=0.5mol/(L•s) |
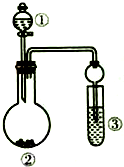 利用如图所示装置(省略加热和夹持装置)进行下列实验,不能得出相应实验结论的是( )
利用如图所示装置(省略加热和夹持装置)进行下列实验,不能得出相应实验结论的是( )| 选项 | ① | ② | ③ | 实验结论 |
| A | 浓氨水 | CaO | 滴有酚酞的水 | 氨气显碱性 |
| B | 浓盐酸 | MnO2 | 淀粉碘化钾溶液 | 氧化性:Cl2>I2 |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均能反应生成白色沉淀 |
| D | 硫酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:硫>碳>硅 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 元素Y、Z、W离子具有相同的电子层结构,其半径依次增大 | |
| B. | 元素X与元素Y可以形成两种共价化合物,且这两种化合物只有一种类型的共价键 | |
| C. | 元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XnR | |
| D. | 元素W、R的最高价氧化物对应水化物都是强酸 |
 ,第一电离能最小的元素的原子轨道表达式
,第一电离能最小的元素的原子轨道表达式 .
. 现有浓度均为0.1mol•L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
现有浓度均为0.1mol•L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题: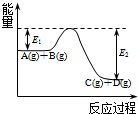 (1)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).丙烷脱氢可得丙烯.
(1)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).丙烷脱氢可得丙烯.