题目内容
12.下列说法中正确的是( )| A. | 原电池中电子流出的极为负极,发生氧化反应 | |
| B. | 原电池中阴离子向正极移动 | |
| C. | 原电池是将电能转化为化学能的装置 | |
| D. | 原电池正极上发生氧化反应 |
分析 A、原电池中电子从负极流出,沿导线进入正极;
B、原电池中阴离子向负极移动,阳离子向正极移动;
C、原电池是将化学能转化为电能的装置;
D、原电池正极上发生还原反应,负极发生氧化反应.
解答 解:A、原电池中电子流出的极为负极,发生氧化反应,故A正确;
B、原电池工作时,电解质中的阴离子向负极移动,故B错误;
C、原电池是将化学能转化为电能的装置,故C错误;
D、原电池的工作时,正极上发生还原反应,负极上发生氧化反应,故D错误.
故选A.
点评 本题考查学生原电池的工作原理和能量转化知识,属于教材知识的考查,较简单.

练习册系列答案
相关题目
2.将铜丝放在酒精灯上加热片刻后,立即浸入乙醇中,反复多次可观察到的现象是( )
| A. | 铜丝在乙醇中变黑 | B. | 铜丝点燃后变红 | ||
| C. | 反应中产生黑烟 | D. | 铜丝在乙醇中变红 |
20.已知Br2跟NaOH溶液的反应类似于Cl2跟NaOH溶液的反应.用溴水作试剂可以将下列各选项中的溶液鉴别出来的是( )
| A. | 水、汽油、酒精 | B. | AgNO3、NaOH、KI | C. | NaCl、NaBr、NaI | D. | 汽油、酒精、NaOH |
1.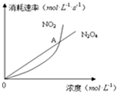 在80℃时,将0.40mol 的N2O4气体充入2L 已经抽成真空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2(g)△H=+56.9kJ/mol,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,将0.40mol 的N2O4气体充入2L 已经抽成真空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2(g)△H=+56.9kJ/mol,隔一段时间对该容器内的物质进行分析,得到如下数据:
(1)计算在80℃时该反应的平衡常数K=1.8.
(2)反应进行至100s 后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”、“变深”或“不变”).
(3)要增大该反应的K值,可采取的措施有D(填序号).
A.增大N2O4起始浓度 B.向混合气体中通入NO2C.使用高效催化剂 D.升高温度
(4)当反应达到平衡后,下列操作,不能使平衡混合气体颜色加深的是D
A.恒温恒容下再通入N2O4气体
B.恒温恒容下再通入NO2气体
C.恒容时,升高温度
D.恒温恒容时通入Ar
E.恒温时压缩体积
(5)图中,交点A表示该反应的所处的状态为B
A.平衡状态 B.朝正反应方向移动C.朝逆反应方向移动 D.无法判断.
 在80℃时,将0.40mol 的N2O4气体充入2L 已经抽成真空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2(g)△H=+56.9kJ/mol,隔一段时间对该容器内的物质进行分析,得到如下数据:
在80℃时,将0.40mol 的N2O4气体充入2L 已经抽成真空的固定容积的密闭容器中,发生如下反应:N2O4(g)?2NO2(g)△H=+56.9kJ/mol,隔一段时间对该容器内的物质进行分析,得到如下数据:| 时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(2)反应进行至100s 后将反应混合物的温度降低,混合气体的颜色变浅(填“变浅”、“变深”或“不变”).
(3)要增大该反应的K值,可采取的措施有D(填序号).
A.增大N2O4起始浓度 B.向混合气体中通入NO2C.使用高效催化剂 D.升高温度
(4)当反应达到平衡后,下列操作,不能使平衡混合气体颜色加深的是D
A.恒温恒容下再通入N2O4气体
B.恒温恒容下再通入NO2气体
C.恒容时,升高温度
D.恒温恒容时通入Ar
E.恒温时压缩体积
(5)图中,交点A表示该反应的所处的状态为B
A.平衡状态 B.朝正反应方向移动C.朝逆反应方向移动 D.无法判断.
2.下列化合物中,既有酸性又能发生酯化反应和消去反应的是( )
| A. | 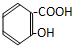 | B. | 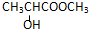 | ||
| C. | CH2=CH-COOH | D. | 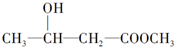 |
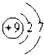 ,第一电离能最小的元素的原子轨道表达式
,第一电离能最小的元素的原子轨道表达式 .
. 现有浓度均为0.1mol•L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
现有浓度均为0.1mol•L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
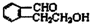 ;
;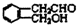 .
. ;此A对应的B生成C的反应:
;此A对应的B生成C的反应: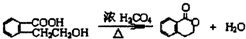 .
.