题目内容
15. 金属镍及其化合物在合金材料以及催化剂等方面应用广泛,请回答下列问题.
金属镍及其化合物在合金材料以及催化剂等方面应用广泛,请回答下列问题.(1)NiO、FeO的晶体结构类型均与氯化钠相同,Ni2+和Fe2+的半径分别为69pm和78pm,则熔点NiO>FeO(填“<”或“>”).
(2)NiO晶胞中Ni和O的配位数分别为6、6.
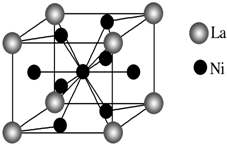
(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示,该合金的化学式为LaNi5或Ni5La.
分析 (1)离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比,与离子所带电荷成正比;
(2)NiO、FeO的晶体结构类型均与氯化钠相同,氯化钠中钠离子和氯离子配位数都是6,据此判断NiO中Ni和O的配位数;
(3)该晶胞中La原子个数=8×$\frac{1}{8}$=1,Ni原子个数=1+8×$\frac{1}{2}$=5,据此确定化学式.
解答 解:(1)离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比,与离子所带电荷成正比,Ni2+和Fe2+的半径分别为69pm和78pm,则Ni2+半径小于Fe2+的半径,两种晶体中阴阳离子所带电荷都相同,所以晶格能NiO>FeO,所以熔点NiO>FeO,故答案为:>;
(2)NiO、FeO的晶体结构类型均与氯化钠相同,氯化钠中钠离子和氯离子配位数都是6,所以NiO中Ni和O的配位数都是6,故答案为:6、6;
(3)该晶胞中La原子个数=8×$\frac{1}{8}$=1,Ni原子个数=1+8×$\frac{1}{2}$=5,该晶胞中La、Ni原子个数之比为1:5,所以化学式为LaNi5或Ni5La,
故答案为:LaNi5或Ni5La.
点评 本题考查晶胞计算及晶体熔沸点大小比较,侧重考查学生空间想象能力及计算能力,利用均摊法分析解答,难点是计算配位数,题目难度不大.

练习册系列答案
相关题目
5.如图所示是气体性质实验的常用装置,下列有关实验现象的说法不正确的是( )
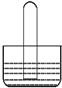

| A. | 若水槽中是水,试管中是NO2,可看到液面上升,若充入一定量的O2可使液体充满整个试管 | |
| B. | 若水槽中是NaOH溶液,试管中是Cl2,可看到液面上升、试管中黄绿色褪去 | |
| C. | 若水槽中是水并滴有几滴紫色石蕊,试管中是SO2,可看到液面上升并变为无色 | |
| D. | 若水槽中是水并滴有几滴酚酞,试管中是NH3,可看到液面上升并呈红色 |
6.对于反应A(g)+3B(g)?2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
| A. | v(A)=0.01 mol/(L•s) | B. | v(B)=0.02 mol/(L•s) | C. | v(B)=0.60mol/(L•s) | D. | v(C)=0.5mol/(L•s) |
10.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.下列说法正确的是( )
| A. | 元素Y、Z、W离子具有相同的电子层结构,其半径依次增大 | |
| B. | 元素X与元素Y可以形成两种共价化合物,且这两种化合物只有一种类型的共价键 | |
| C. | 元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XnR | |
| D. | 元素W、R的最高价氧化物对应水化物都是强酸 |
20.已知Br2跟NaOH溶液的反应类似于Cl2跟NaOH溶液的反应.用溴水作试剂可以将下列各选项中的溶液鉴别出来的是( )
| A. | 水、汽油、酒精 | B. | AgNO3、NaOH、KI | C. | NaCl、NaBr、NaI | D. | 汽油、酒精、NaOH |
5.下列说法正确的是( )
| A. | 一种元素可能形成多种氧化物,但同价态的氧化物只有一种 | |
| B. | 明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同 | |
| C. | 已知K2O、K2O2、KO2的名称依次是氧化钾、过氧化钾、超氧化钾,则BaO2的名称是过氧化钡 | |
| D. | 由共价键形成的物质一定是共价化合物 |
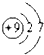 ,第一电离能最小的元素的原子轨道表达式
,第一电离能最小的元素的原子轨道表达式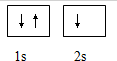 .
. 现有浓度均为0.1mol•L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
现有浓度均为0.1mol•L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题: