题目内容
17.下面是我们熟悉的物质:①O2 ②Na2O2 ③CaCl2④Na2CO3⑤H2SO4 ⑥NH4Cl ⑦CO2 ⑧Ne ⑨金刚石 ⑩Na2S(1)这些物质中,只含有共价键的是①⑤⑦⑨;(填序号)只含有离子键的是③⑩.(填序号)
(2)属于共价化合物的是⑤⑦.(填序号)
(3)⑥的电子式为
 .⑦的电子式为
.⑦的电子式为 .
.
分析 (1)一般来说活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性共价键;
(2)只含共价键的化合物是共价化合物;
(3)结合成键特点以及离子化合物、共价化合物的区别书写电子式.
解答 解:①O2中O原子之间只存在非极性共价键,为单质;
②Na2O2中钠离子和过氧根离子之间存在离子键、O原子之间存在非极性共价键,为离子化合物;
③CaCl2中钙离子和氯离子之间只存在离子键,为离子化合物;
④Na2CO3中钠离子和碳酸根离子之间存在离子键、C原子和O原子之间存在极性共价键,为离子化合物;
⑤H2SO4中S原子和O原子、O原子和H原子之间存在极性共价键,为共价化合物;
⑥NH4Cl中铵根离子和氯离子之间存在离子键、N原子和H原子之间存在极性共价键,为离子化合物;
⑦CO2中C原子和O原子之间存在极性共价键,为共价化合物;
⑧Ne中不存在化学键;
⑨金刚石中碳原子之间只存在非极性共价键;
⑩Na2S中钠离子和硫离子之间只存在离子键,为离子化合物.
(1)只含有共价键的是①⑤⑦⑨,只含有离子键的是③⑩,故答案为:①⑤⑦⑨;③⑩;
(2)属于共价化合物的是⑤⑦,故答案为:⑤⑦;
(3)氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为: ;
;
二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: ,
,
故答案为: ;
; .
.
点评 本题考查了物质和化学键的关系,根据物质的构成微粒确定化学键,知道离子键和共价键的区别,注意稀有气体中不存在化学键,为易错点.

练习册系列答案
相关题目
5.如图所示是气体性质实验的常用装置,下列有关实验现象的说法不正确的是( )
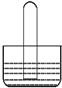

| A. | 若水槽中是水,试管中是NO2,可看到液面上升,若充入一定量的O2可使液体充满整个试管 | |
| B. | 若水槽中是NaOH溶液,试管中是Cl2,可看到液面上升、试管中黄绿色褪去 | |
| C. | 若水槽中是水并滴有几滴紫色石蕊,试管中是SO2,可看到液面上升并变为无色 | |
| D. | 若水槽中是水并滴有几滴酚酞,试管中是NH3,可看到液面上升并呈红色 |
2.将铜丝放在酒精灯上加热片刻后,立即浸入乙醇中,反复多次可观察到的现象是( )
| A. | 铜丝在乙醇中变黑 | B. | 铜丝点燃后变红 | ||
| C. | 反应中产生黑烟 | D. | 铜丝在乙醇中变红 |
9.A、B、C都是短周期元素,原子序数依次增大.B是地壳中含量最多的元素;化合物AxBy有多种形式,有的可以导致酸雨;离子化合物CmBn也有不同形式,其中m:n可以是2:1或1:1.下列正确的是( )
| A. | 原子半径由大到小的顺序是:C>B>A | |
| B. | AxBy中A的化合价不可能为+1价 | |
| C. | C与B形成的化合物溶于水都能得到单质B | |
| D. | A、B两元素的气态氢化物可以相互反应 |
6.对于反应A(g)+3B(g)?2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是( )
| A. | v(A)=0.01 mol/(L•s) | B. | v(B)=0.02 mol/(L•s) | C. | v(B)=0.60mol/(L•s) | D. | v(C)=0.5mol/(L•s) |
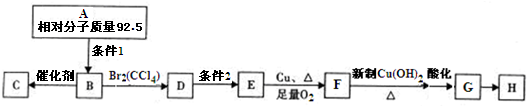
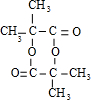 .
. ;
;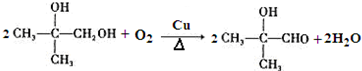 .
. )的合成路线为
)的合成路线为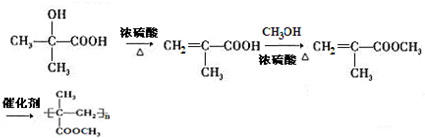 .
. 现有浓度均为0.1mol•L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
现有浓度均为0.1mol•L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题: