题目内容
【题目】目前铬被广泛应用于冶金、化工、铸铁及高精端科技等领域。回答下列问题:
(1)基态Cr原子价层电子的轨道表达式为_______,其核外有_______种不同能量的电子。
(2)Cr的第二电能离(ICr)和Mn的第二电离能(IMn)分别为1590.6 kJ·mol-1、1509.0 kJ·mol-1,ICr > IMn的原因是____________。
(3)过氧化铬CrO5中Cr的化合价为+6,则该分子中![]() 键、
键、![]() 键的数目之比为______。
键的数目之比为______。
(4)CrCl3的熔点(83℃)比CrF3的熔点(1100℃)低得多,这是因为___________。
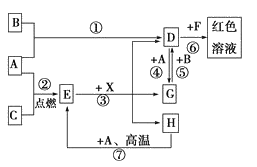
(5)Cr的一种配合物结构如图所示,该配合物中碳原子的杂化方式是_______,阳离子中Cr原子的配位数为_________,ClO![]() 的立体构型为________。
的立体构型为________。

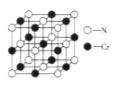
(6)氮化铬晶体的晶胞结构如图所示,Cr处在N所围成的________空隙中,如果N与Cr核间距离为apm,则氮化铬的密度计算式为__________g·cm-3(NA表示阿伏加德罗常数的值)。
【答案】![]() 7 Cr失去1个e-后,3d轨道处于半充满状态,不易失去电子,Mn失去2个e-后,才处于半充满状态 7:1 CrCl3为分子晶体,CrF3是离子晶体 sp、sp3 6 正四面体形 正八面体
7 Cr失去1个e-后,3d轨道处于半充满状态,不易失去电子,Mn失去2个e-后,才处于半充满状态 7:1 CrCl3为分子晶体,CrF3是离子晶体 sp、sp3 6 正四面体形 正八面体 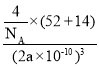 g/cm3或
g/cm3或![]() g/cm3
g/cm3
【解析】
过渡元素的价层电子包括最外层电子和次外层d能级,不同的能级,能量是不同;从它们的第一电离能的电子排布式角度进行分析;利用化合价代数和为0进行分析;从晶体熔沸点判断;杂化轨道数等于价层电子对数,从配合物结构进行分析;根据晶胞的结构进行分析;
(1)Cr位于第四周期VIB族,价层电子排布式为3d54s1,其轨道表达式为![]() ;基态Cr的电子排布式为1s22s22p63s23p63d54s1,有7个能级,因此核外有7种不同能量的电子;
;基态Cr的电子排布式为1s22s22p63s23p63d54s1,有7个能级,因此核外有7种不同能量的电子;
(2)Cr失去1个e-后,价电子排布式为3d5,Mn失去1个e-后,价电子排布式为3d54s1,前者3d为半充满,不易失去电子;
(3)令-1价O原子个数为a,-2价O原子的个数为b,则有a+2b=6,a+b=5,解得a=4,b=1,Cr为+6价,从而推出CrO5的结构简式为![]() ,即
,即![]() 键、
键、![]() 键的数目之比为7:1;
键的数目之比为7:1;
(4)CrCl3为分子晶体,CrF3为离子晶体,一般离子晶体的熔沸点高于分子晶体;
(5)根据配合物结构,“C=S”中C的杂化方式为sp,饱和碳的杂化方式为sp3;该配合物中,Cr与6个N原子形成6个配位键,即Cr的配位数为6;ClO4-中有4个σ键,孤电子对数为![]() =0,价层电子对数为4,空间构型为正四面体形;
=0,价层电子对数为4,空间构型为正四面体形;
(6)根据氮化铬的晶胞结构,Cr处于N所围成正八面体空隙中;Cr位于晶胞的棱上和体心,利用均摊法,其个数为![]() =4,N位于顶点和面心,个数为
=4,N位于顶点和面心,个数为![]() =4,化学式为CrN,晶胞的质量为
=4,化学式为CrN,晶胞的质量为![]() ,根据晶胞的结构,晶胞的边长为为2apm,即为2a×10-10cm,根据密度的定义,该晶胞的密度为
,根据晶胞的结构,晶胞的边长为为2apm,即为2a×10-10cm,根据密度的定义,该晶胞的密度为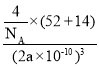 g/cm3或
g/cm3或![]() g/cm3。
g/cm3。