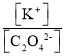题目内容
【题目】现用18.4 mol/L的浓H2SO4来配制500mL0.2 mol/L的稀H2SO4。可供选择的仪器有:①玻璃棒②烧瓶③烧杯④胶头滴管⑤量筒⑥托盘天平⑦药匙。
请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时不需要使用的有_____________(填代号),还缺少的仪器是______________________。
(2)经计算,需浓H2SO4的体积为___________,量取浓硫酸时应选用___________(填序号)(选填①10mL、②50mL、③100mL三种规格)的量筒。
(3)将所配制的稀H2SO4进行测定,发现浓度小于0.2 mol/L。请你分析配制过程中可能引起浓度偏低的原因是___________(填字母)。
a.定容时俯视标线 b.烧杯和玻璃棒没有洗涤
c.加蒸馏水不慎超过刻度线 d.容量瓶使用前内壁沾有水珠
e.定容时仰视标线
【答案】②⑥⑦ 500mL容量瓶 5.4mL ① bce
【解析】
(1)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
(2)根据稀释前后硫酸的物质的量不变求出浓H2SO4的体积;根据溶液的体积选取稍大的量筒;
(3)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=![]() 分析判断。
分析判断。
(1)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)量取浓硫酸,在烧杯中稀释,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:玻璃棒、烧杯、胶头滴管、量筒、500mL容量瓶,不需要的仪器有②⑥⑦;还缺少的仪器是500mL容量瓶;
(2)稀释前后硫酸的物质的量不变,设浓H2SO4的体积为VmL,则18.4mol/L×VmL=500mL×0.2mol/L,解得V=5.4mL,选用量筒的规格为10mL,故选①;
(3)a、定容时俯视刻度线,使溶液的体积偏小,所以溶液浓度偏高,故不选a;
b、烧杯和玻璃棒没有洗涤,硫酸的物质的量偏小,所以溶液浓度偏低,故选b;
c、加蒸馏水不慎超过刻度线,使溶液的体积偏大,所以溶液浓度偏低,故选c;
d.定容时需要加水,所以容量瓶使用前内壁沾有水珠,对溶液浓度无影响,故不选d;
e、定容时仰视刻度线,使溶液的体积偏大,所以溶液浓度偏低,故选e。

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案