题目内容
【题目】标况下将8.96 L氯化氢气体溶于水形成100 mL溶液,然后与足量的铁屑反应。
(1)所得盐酸溶液的物质的量浓度是多少________?
(2)参加反应的铁的质量是多少________?
(3)标况下生成氢气的体积是多少________?
(4)将生成的氯化亚铁配成400 mL溶液,此溶液中氯化亚铁的物质的量浓度是多少________?
【答案】4 mol·L-1 11.2g 4.48L 0.5mol·L-1
【解析】
(1)n(HCl)=![]() =0.4mol,根据c(HCl)=
=0.4mol,根据c(HCl)=![]() 计算溶液物质的量浓度;
计算溶液物质的量浓度;
(2)根据盐酸和铁之间的关系式计算Fe的质量;
(3)足量Fe和稀盐酸反应生成氢气,根据H原子守恒计算生成氢气体积;
(4)根据Cl原子守恒计算FeCl2的物质的量,再根据c=![]() 计算溶液物质的量浓度;
计算溶液物质的量浓度;
(1)所得盐酸的物质的量浓度=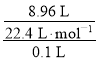 =4 mol·L-1,
=4 mol·L-1,
故答案为:4 mol·L-1;
(2)根据铁和盐酸反应的方程式:Fe+2HCl=FeCl2+H2↑,参加反应的铁的质量=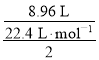 ×
×![]() =11.2 g,
=11.2 g,
故答案为:11.2g;
(3)根据H原子守恒,HCl中的H全部生成了氢气,所以标况下生成氢气的体积=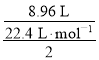 ×22.4 L·mol-1=4.48 L,
×22.4 L·mol-1=4.48 L,
故答案为:4.48L;
(4)氯化亚铁的物质的量和参加反应的铁的物质的量相等,所以氯化亚铁的物质的量浓度= =0.5 mol·L-1,
=0.5 mol·L-1,
故答案为:0.5mol·L-1。

练习册系列答案
相关题目