题目内容
【题目】用“双线桥”标出电子转移的方向和数目,并分别指出 氧化剂和氧化产物。
(1)Fe+CuSO4=FeSO4+Cu ________ 氧化剂是 ____________氧化产物是_____________,
(2)3CO+Fe2O3![]() 3CO2+2Fe ________ 氧化剂是 ____________氧化产物是_____________,
3CO2+2Fe ________ 氧化剂是 ____________氧化产物是_____________,
【答案】 CuSO4 FeSO4
CuSO4 FeSO4 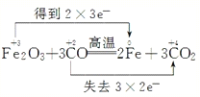 Fe2O3 CO2
Fe2O3 CO2
【解析】
根据氧化还原反应中得失电子守恒进行配平,并分析氧化剂、还原剂、氧化产物、还原产物。
(1)反应方程式Fe+CuSO4=FeSO4+Cu中化合价变化为:Fe→FeSO4,Fe元素由0价→+2价,一个Fe原子失2个电子,所以Fe是还原剂,FeSO4是氧化产物;CuSO4→Cu,Cu元素由+2价→0价,一个CuSO4得2个电子,所以CuSO4是氧化剂,Cu是还原产物;其得失电子的最小公倍数是2,所以其转移电子数为2,用“双线桥”标出电子转移的方向和数目为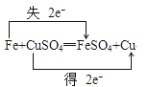 ;氧化剂为CuSO4;氧化产物为FeSO4;
;氧化剂为CuSO4;氧化产物为FeSO4;
(2)反应方程式3CO+Fe2O3![]() 3CO2+2Fe中化合价变化为:CO→CO2,C元素由+2价→+4价,一个CO分子失2个电子,所以CO是还原剂,CO2是氧化产物;Fe2O3→Fe,Fe元素由+3价→0价,一个Fe2O3得6个电子,所以Fe2O3是氧化剂,Fe是还原产物;其得失电子的最小公倍数是6,所以其转移电子数为6,用“双线桥”标出电子转移的方向和数目为
3CO2+2Fe中化合价变化为:CO→CO2,C元素由+2价→+4价,一个CO分子失2个电子,所以CO是还原剂,CO2是氧化产物;Fe2O3→Fe,Fe元素由+3价→0价,一个Fe2O3得6个电子,所以Fe2O3是氧化剂,Fe是还原产物;其得失电子的最小公倍数是6,所以其转移电子数为6,用“双线桥”标出电子转移的方向和数目为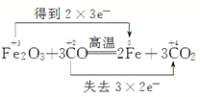 ;氧化剂为Fe2O3;氧化产物为CO2。
;氧化剂为Fe2O3;氧化产物为CO2。

练习册系列答案
相关题目