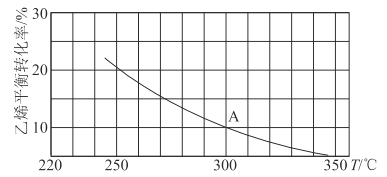
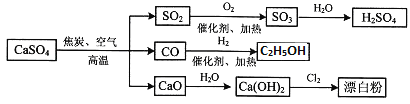
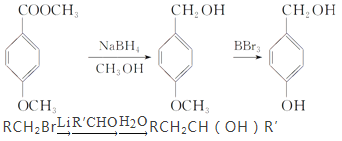
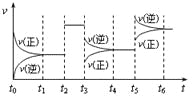
题目内容
【题目】在一定温度下的定容密闭容器中,下列情况表明反应A(s)+2B(g)![]() C(g)+D(g) 已达到反应限度的是
C(g)+D(g) 已达到反应限度的是
A. 混合气体的密度保持不变B. 有1mol C生成的同时有1mol D生成
C. 混合气体的总物质的量保持不变D. 有1 mol A生成的同时有1mol C消耗
【答案】A
【解析】
A、![]() ,A是固体,气体总质量是变量,容器体积不变,所以密度是变量,混合气体的密度不变,说明反应达平衡状态,故选A;
,A是固体,气体总质量是变量,容器体积不变,所以密度是变量,混合气体的密度不变,说明反应达平衡状态,故选A;
B、C、D都是生成物,任意时刻生成C、D的比一定等于系数比,生成1molC的同时生成1molD不一定平衡,故不选B;
C、反应前后气体系数和相等,气体总物质的量始终不变,所以气体总物质的量不变不一定达到平衡状态,故不选C;
D、根据反应方程式,生成A和消耗C是的指逆反应,生成1molA的同时消耗1molC不一定平衡,故不选D。
答案选A。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.5 mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出320.8 kJ的热量。
(1)肼的电子式为___________________,过氧化氢的电子式为__________________。
(2)写出反应的热化学方程式:________________________________________________。
(3)在25 ℃、101 kPa时,已知18 g水蒸气变成液态水放出44 kJ的热量。其他相关数据如下表:
O===O | H—H | H—O(g) | |
1 mol化学键断裂时 需要吸收的能量/kJ | 496 | 436 | 463 |
写出表示H2燃烧热的热化学方程式___________________________________________;则32 g液态肼与足量液态过氧化氢反应生成氮气和液态水时,放出的热量是________kJ。
(4)联氨和H2O2可作为火箭推进剂的主要原因为_________________________________。
(5)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为____________(已知:N2H4+H+![]() N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为_______________。
N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为_______________。