题目内容
【题目】(1)鉴别KCl溶液和K2CO3的试剂是___________,离子方程式为________________。
(2)除去混入NaCl溶液中少量NaHCO3杂质的试剂是________,离子方程式为___________。
(3)除去Na2CO3粉末中混入的NaHCO3杂质用________方法,化学方程式为_____________。
(4)除去铁粉中混有铝粉的试剂是___________,离子方程式为_________________________。
【答案】盐酸 CO32-+2H+=CO2↑+H2O 盐酸 HCO3-+H+=CO2↑+H2O 加热 2NaHCO3![]() Na2CO3+CO2↑+H2O 氢氧化钠溶液 2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑
Na2CO3+CO2↑+H2O 氢氧化钠溶液 2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑
【解析】
(1) KCl与盐酸不反应, K2CO3与盐酸反应放出二氧化碳气体;
(2) NaHCO3与盐酸反应生成氯化钠、二氧化碳、水;
(3) NaHCO3加热分解为碳酸钠、二氧化碳、水;
(4)铁粉与氢氧化钠溶液不反应、铝粉与氢氧化钠溶液反应生成偏铝酸钠和氢气;
(1) KCl与盐酸不反应, K2CO3与盐酸反应放出二氧化碳气体,所以用盐酸鉴别KCl溶液和K2CO3,反应的离子方程式是CO32-+2H+=CO2↑+H2O;
(2) NaHCO3与盐酸反应生成氯化钠、二氧化碳、水,用盐酸除去混入NaCl溶液中少量NaHCO3杂质,反应的离子方程式是HCO3-+H+=CO2↑+H2O;
(3) NaHCO3加热分解为碳酸钠、二氧化碳、水,加热可以除去Na2CO3粉末中混入的NaHCO3杂质,反应方程式是2NaHCO3![]() Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
(4)铁粉与氢氧化钠溶液不反应、铝粉与氢氧化钠溶液反应生成偏铝酸钠和氢气,用氢氧化钠溶液除去铁粉中混有的铝粉,反应的离子方程式是2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑;

【题目】呋喃甲酸俗称糠酸,广泛应用于塑料工业、食品行业、涂料、医药、香料等。用呋喃甲醛制备呋喃甲酸和副产品呋喃甲醇的原理为:
反应1:![]() +NaOH
+NaOH![]()
![]() △H<0
△H<0
反应2:![]() +HCl
+HCl![]()
![]() +HCl
+HCl
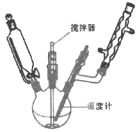
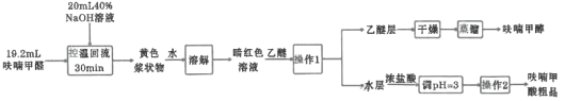
某研究性学习小组利用上图装置制备呋喃甲酸的实验流程如下:
已知:①乙醚(![]() )沸点34.6℃,其蒸气有毒,可使人失去知觉。
)沸点34.6℃,其蒸气有毒,可使人失去知觉。
②主要试剂相关物理性质如下:
试剂 | 相对分子质量 | 密度/ | 熔点/℃ | 沸点/℃ | 溶解性 |
呋喃甲醛 | 96 | 1.16 |
| 161.7 | 微溶于水,易溶于乙醇、乙醚。 |
呋喃甲醇 | 98 | 1.13 |
| 171.0 | 溶于水,可混溶于乙醇、乙醚。 |
呋喃甲酸 | 112 | - | 129.5 | 231.0 | 微溶于冷水,在热水中溶解度较大,易溶于乙醇、乙醚。 |
请回答下列问题:
(1)“控温回流”时需控制反应温度8~12℃,应采取的控温方式是________,三颈烧瓶中所加入的![]() 溶液应如何预处理________,滴加呋喃甲醛时需________。
溶液应如何预处理________,滴加呋喃甲醛时需________。
(2)在“控温回流”时充分搅拌才能获得较高产率。其原因是________。
(3)“操作1”的名称为________,所用到的玻璃仪器主要有________,“操作2”主要包括________、________。
(4)“蒸馏”时,用下图________(填字母标号)装置更好,与另一装置相比,该装置的优点有①________;②________。
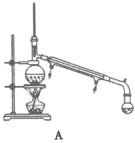
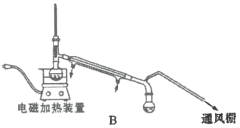
(5)呋喃甲酸粗品精制所采用的方法是________,最终得到精产品9.86g,呋喃甲酸的产率为________。