题目内容
18.下列解释实验现象的方程式不正确的是( )| A. | 向盛有少量Mg(OH)2沉淀的试管中滴加适量NH4Cl溶液,沉淀溶解:Mg(OH)2+2NH4+═2NH3•H2O+Mg2+ | |
| B. | SO2通入澄清石灰水中,产生白色沉淀:SO2+Ca2++2OH-═CaSO4↓+H2O | |
| C. | 向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++2 HCO3-+2 OH-═CaCO3↓+CO32-+2H2O | |
| D. | 长期过量服用阿司匹林出现水杨酸(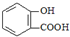 )反应,可静脉注滴NaHCO3溶液: )反应,可静脉注滴NaHCO3溶液: |
分析 A.滴加适量NH4Cl溶液,铵根离子结合氢氧根离子,促进氢氧化镁的溶解;
B.白色沉淀为CaSO3;
C.加入过量NaOH溶液,反应生成碳酸钙、碳酸钠和水;
D.只有-COOH与NaHCO3溶液反应.
解答 解:A.向盛有少量Mg(OH)2沉淀的试管中滴加适量NH4Cl溶液,沉淀溶解,发生离子反应为Mg(OH)2+2NH4+═2NH3•H2O+Mg2+,故A正确;
B.SO2通入澄清石灰水中,产生白色沉淀的离子反应为SO2+Ca2++2OH-═CaSO3↓+H2O,故B错误;
C.向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成的离子反应为Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O,故C正确;
D.长期过量服用阿司匹林出现水杨酸( )反应,可静脉注滴NaHCO3溶液的离子反应为
)反应,可静脉注滴NaHCO3溶液的离子反应为 ,故D正确;
,故D正确;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、与量有关的离子反应考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
8.下列实验装置、试剂选用或操作正确的是( )
| A. | 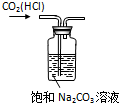 除CO2中的HCl | B. | 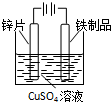 铁制品上镀锌 | C. |  吸收氨气 | D. |  制备少量O2 |
6.有五种短周期主族元素X、Y、Z、W、Q,其中Q的单质是密度最小的气体,X原子的最外层电子数是内层电子数的2倍,Y和W同主族且原子序数之比为2:1,Z是短周期中原子半径最大的元素.下列叙述错误的是( )
| A. | XQ2W分子在常温下呈气态,分子中的四个原子在同一平面内 | |
| B. | Z和W形成的两种离子化合物中阴、阳离子个数比均为2:1 | |
| C. | X、W两元素分别和Q元素化合,可形成电子数相同的两种化合物 | |
| D. | 相应的离子半径大小关系为:Y>W>Z |
13.下列说法正确的是( )
| A. | 向水中加入少量固体硫酸氢钠,恢复原温度时,c(H+)增大,Kw变大 | |
| B. | 体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量),后者用时少 | |
| C. | 0.1 mol.L-1的醋酸溶液加水稀释,$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 | |
| D. | 常温下,V1LpH=11的NaOH溶液与V2LpH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
3.25℃时,下列各组离子在指定溶液中能大量共存的是( )
| A. | pH=1的溶液中:Na+、NH4+、SO42-、ClO- | |
| B. | KW/c(H+)=0.1 mol•L-1的溶液中:Na+、K+、MnO4-、HCO3- | |
| C. | 0.1 mol•L-1的Na2SO3溶液中:K+、H+、SO42-、NO3- | |
| D. | 澄清透明的溶液中:Fe3+、Na+、Cl-、SO42- |
2.某化学研究小组设计如下微型实验探究SO2的化学性质.已知棉球b沾有含酚酞的NaOH溶液.当滴入浓硫酸片刻后发现:棉球a变白,微热后又恢复红色;棉球c变白.以下说法不正确的是( )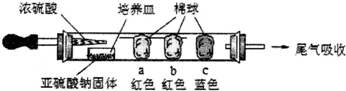

| A. | 本实验是利用强酸制弱酸原理制得SO2气体 | |
| B. | 棉球a沾有品红试液,用以验证SO2的漂白性 | |
| C. | 棉球b红色褪去,说明SO2是酸性氧化物,与水反应能生成亚硫酸 | |
| D. | 棉球C沾有含石蕊的NaOH溶液 |
3.在密闭容器中进行反应:X(g)+3Y(g)?2Z(g),有关下列图象的说法不正确的是( )
| A. | 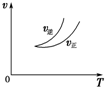 可判断正反应为放热反应 | |
| B. | 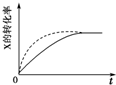 虚线表示可能使用了催化剂或是加压 | |
| C. | 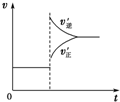 若正反应的△H<0,可表示升高温度使平衡向逆反应方向移动 | |
| D. | 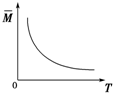 气体平均相对分子质量随温度变化情况,可推知正反应的△H>0 |
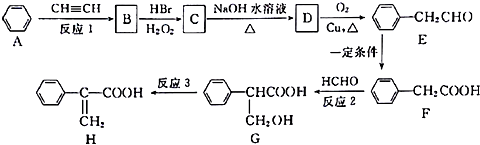
 .
. +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$ +NaBr.
+NaBr. .
.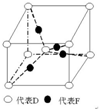 在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子.
在元素周期表前四周期中原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子. ; A2D由液态形成晶体时密度减小(填增大,不变或减小),分析主要原因(用文字叙述)水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小.
; A2D由液态形成晶体时密度减小(填增大,不变或减小),分析主要原因(用文字叙述)水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小.