题目内容
2.某化学研究小组设计如下微型实验探究SO2的化学性质.已知棉球b沾有含酚酞的NaOH溶液.当滴入浓硫酸片刻后发现:棉球a变白,微热后又恢复红色;棉球c变白.以下说法不正确的是( )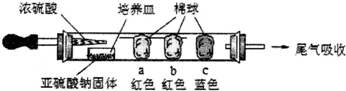
| A. | 本实验是利用强酸制弱酸原理制得SO2气体 | |
| B. | 棉球a沾有品红试液,用以验证SO2的漂白性 | |
| C. | 棉球b红色褪去,说明SO2是酸性氧化物,与水反应能生成亚硫酸 | |
| D. | 棉球C沾有含石蕊的NaOH溶液 |
分析 A.亚硫酸钠与浓硫酸反应生成硫酸钠和二氧化硫气体,利用了强酸制取弱酸的原理;
B.二氧化硫具有漂白性,能够使品红溶液褪色;
C.二氧化硫属于酸性氧化物,能和强碱反应生成盐和水;
D.含石蕊的氢氧化钠溶液为蓝色,遇到二氧化硫后变成红色,不会变白.
解答 解:A.硫酸的酸性反应亚硫酸,所以能够用浓硫酸与亚硫酸钠反应制取二氧化硫,故A正确;
B.红色棉球变白,微热后又恢复红色,说明二氧化硫使品红溶液褪色,则棉球上滴有品红溶液,该实验说明二氧化硫具有漂白性,故B正确;
C.二氧化硫属于酸性氧化物,能和NaOH溶液反应生成亚硫酸钠和水或亚硫酸氢钠,导致溶液碱性减弱,所以棉球变为白色,离子方程式为:SO2+2OH-=SO32-+H2O,故C正确;
D.碘遇淀粉试液变蓝色,二氧化硫具有还原性,碘具有氧化性,二者反应生成氢碘酸和硫酸,所以棉球变为白色,离子方程式为:SO2+I2+2H2O=4H++SO42-+2I-,该实验说明二氧化硫具有还原性,所以C处为碘单质与淀粉的溶液,故D错误;
故选D.
点评 本题考查了二氧化硫的制取、性质及检验方法,题目难度中等,明确实验原理及常见物质的性质为解答关键,注意掌握二氧化硫的化学性质及检验方法,试题培养了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
18.下列解释实验现象的方程式不正确的是( )
| A. | 向盛有少量Mg(OH)2沉淀的试管中滴加适量NH4Cl溶液,沉淀溶解:Mg(OH)2+2NH4+═2NH3•H2O+Mg2+ | |
| B. | SO2通入澄清石灰水中,产生白色沉淀:SO2+Ca2++2OH-═CaSO4↓+H2O | |
| C. | 向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++2 HCO3-+2 OH-═CaCO3↓+CO32-+2H2O | |
| D. | 长期过量服用阿司匹林出现水杨酸(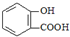 )反应,可静脉注滴NaHCO3溶液: )反应,可静脉注滴NaHCO3溶液: |
15.下列物质属于油脂的是( )
| A. | 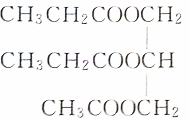 | B. | 润滑油 | ||
| C. | 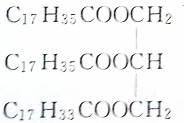 | D. | 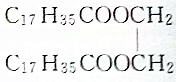 |
2.下列关于苯的叙述中错误的是( )
| A. | 苯在催化剂作用下能与液溴发生取代反应 | |
| B. | 在苯中加入酸性KMnO4溶液,振荡并静置后下层液体为紫色 | |
| C. | 在苯中加入溴水,振荡并静置后下层液体为橙色 | |
| D. | 在一定条件下,苯能与氢气发生加成反应 |
7.已知四种元素的原子半径如表所示:
根据表中数据推测磷元素的原子半径可能是( )
| 元素 | N | S | O | Si |
| 原子半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
| A. | 0.80×10-10m | B. | 1.20×10-10m | C. | 1.10×10-10m | D. | 0.70×10-10m |
14.下列有机物分子中,所有碳原子不可能处于同一平面的是( )
| A. | 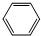 | B. | HC≡C-CH3 | C. |  | D. | 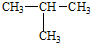 |
11.下列各组物质中,互为同分异构体的是( )
| A. | ${\;}_{1}^{2}$H和${\;}_{1}^{3}$H | B. | H2O和H2O2 | ||
| C. | CH4和CH3CH3 | D. | 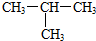 和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |
12.短周期的A、B、C、D、E五种元素,原子序数依次增大.已知元素A的简单气态氢化物和它的最高价氧化物的水化物反应生成盐;B、E为同主族元素,且B元素原子最外层电子数是次外层的3倍; C是短周期中与水反应最激烈的金属元素;A、D最外层电子数相差2.下列说法错误的是( )
| A. | 原子半径:A>B | |
| B. | 失电子的能力:C<D | |
| C. | 简单气态氢化物的稳定性:B>E | |
| D. | 元素C、D、E的最高价氧化物对应的水化物两两之间能发生反应 |
 .
.