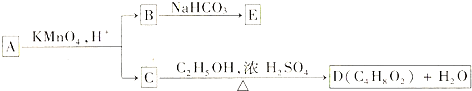题目内容
6.有五种短周期主族元素X、Y、Z、W、Q,其中Q的单质是密度最小的气体,X原子的最外层电子数是内层电子数的2倍,Y和W同主族且原子序数之比为2:1,Z是短周期中原子半径最大的元素.下列叙述错误的是( )| A. | XQ2W分子在常温下呈气态,分子中的四个原子在同一平面内 | |
| B. | Z和W形成的两种离子化合物中阴、阳离子个数比均为2:1 | |
| C. | X、W两元素分别和Q元素化合,可形成电子数相同的两种化合物 | |
| D. | 相应的离子半径大小关系为:Y>W>Z |
分析 有五种短周期主族元素X、Y、Z、W、Q,其中Q的单质是密度最小的气体,则Q为H元素;X原子的最外层电子数是内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故X为C元素;Y和W同主族且原子序数之比为2:1,则Y为S元素、W为O元素;Z是短周期中原子半径最大的元素,则Z为Na,据此解答.
解答 解:有五种短周期主族元素X、Y、Z、W、Q,其中Q的单质是密度最小的气体,则Q为H元素;X原子的最外层电子数是内层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故X为C元素;Y和W同主族且原子序数之比为2:1,则Y为S元素、W为O元素;Z是短周期中原子半径最大的元素,则Z为Na.
A.CH2O为甲醛,分子在常温下呈气态,分子中C原子没有孤电子对,为平面三角形结构,分子中的四个原子在同一平面内,故A正确;
B.Z和W形成的两种离子化合物为Na2O、Na2O2,晶体中阴、阳离子个数比均为1:2,故B错误;
C.C、O两元素分别和H元素化合得到CH4、H2O均为10电子分子,可以得到18电子分子C2H6、H2O2,故C正确;
D.电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->O2->Na+,故D正确,
故选:B.
点评 本题考查位置结构性质关系应用,推断元素是解题关键,注意C选项中掌握常见10电子、18电子微粒.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.下列实验能达到目的是( )
| A. |  测定乙醇结构式 | B. | 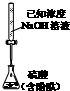 测定硫酸浓度 | ||
| C. | 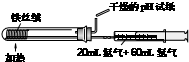 合成并检验氨 | D. | 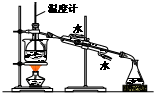 分离并回收硝基苯中的苯 |
1.钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).
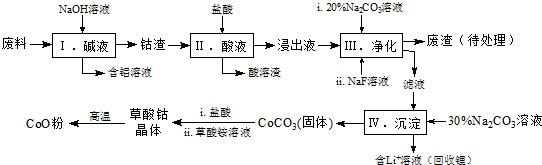
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表.
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O.
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15;废渣中的主要成分除了LiF外,还有Fe(OH)3.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是降低滤液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀.
(5)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
①加热到210℃时,固体质量减轻的原因是失去结晶水.
②经测定,加热到210~290℃过程中的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为:3CoC2O4+2O2 Co3O4+6CO2.[已知M(CoC2O4•2H2O)=183g/mol].
Co3O4+6CO2.[已知M(CoC2O4•2H2O)=183g/mol].

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表.
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O.
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15;废渣中的主要成分除了LiF外,还有Fe(OH)3.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是降低滤液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀.
(5)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
②经测定,加热到210~290℃过程中的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为:3CoC2O4+2O2
 Co3O4+6CO2.[已知M(CoC2O4•2H2O)=183g/mol].
Co3O4+6CO2.[已知M(CoC2O4•2H2O)=183g/mol].
11.化学与材料、生活和环境密切相关.下列有关说法中错误的是( )
| A. | 利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用 | |
| B. | 日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 | |
| C. | 煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 | |
| D. | 神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是单晶硅 |
18.下列解释实验现象的方程式不正确的是( )
| A. | 向盛有少量Mg(OH)2沉淀的试管中滴加适量NH4Cl溶液,沉淀溶解:Mg(OH)2+2NH4+═2NH3•H2O+Mg2+ | |
| B. | SO2通入澄清石灰水中,产生白色沉淀:SO2+Ca2++2OH-═CaSO4↓+H2O | |
| C. | 向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++2 HCO3-+2 OH-═CaCO3↓+CO32-+2H2O | |
| D. | 长期过量服用阿司匹林出现水杨酸(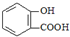 )反应,可静脉注滴NaHCO3溶液: )反应,可静脉注滴NaHCO3溶液: |
15.下列物质属于油脂的是( )
| A. | 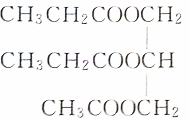 | B. | 润滑油 | ||
| C. | 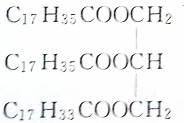 | D. | 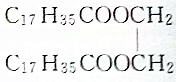 |
11.下列各组物质中,互为同分异构体的是( )
| A. | ${\;}_{1}^{2}$H和${\;}_{1}^{3}$H | B. | H2O和H2O2 | ||
| C. | CH4和CH3CH3 | D. | 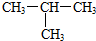 和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |
 .
.