题目内容
13.下列说法正确的是( )| A. | 向水中加入少量固体硫酸氢钠,恢复原温度时,c(H+)增大,Kw变大 | |
| B. | 体积、pH均相同的醋酸和盐酸完全溶解等量的镁粉(少量),后者用时少 | |
| C. | 0.1 mol.L-1的醋酸溶液加水稀释,$\frac{c({H}^{+})}{c(O{H}^{-})}$减小 | |
| D. | 常温下,V1LpH=11的NaOH溶液与V2LpH=3的HA溶液混合,若混合液显中性,则V1≤V2 |
分析 A.Kw只与温度有关;
B.醋酸为弱电解质,等pH时,醋酸浓度大;
C.醋酸加水稀释c(H+)减小,c(OH-)增大;
D.如HA为强酸,则V1=V2,如HA为弱酸,HA的浓度较大.
解答 解:A.向水中加入少量固体硫酸氢钠,恢复原温度时,c(H+)增大,Kw只与温度有关,则Kw不变,故A错误;
B.醋酸为弱电解质,等pH时,醋酸浓度大,反应速率大,用时少,故B错误;
C.醋酸加水稀释c(H+)减小,c(OH-)增大,则$\frac{c({H}^{+})}{c(O{H}^{-})}$减小,故C正确;
D.如HA为强酸,则V1=V2,如HA为弱酸,HA的浓度较大,消耗的氢氧化钠的体积偏大,则V1>V2,故D错误.
故选C.
点评 本题综合考查弱电解质的电离以及平衡移动的影响因素,注意弱酸溶液在稀释时溶液中离子浓度的变化,题目难度中等.

练习册系列答案
相关题目
3.火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2-→Cu2S+2FeS+SO2下列说法正确的是( )
| A. | SO2是氧化产物 | |
| B. | CuFeS2仅作还原剂,硫元素被氧化 | |
| C. | 每生成1mol Cu2S,有4mol硫被氧化 | |
| D. | 每转移1.2mol电子,有0.2mol硫被氧化 |
4.下列说法正确的是( )
| A. | 油脂水解可得到氨基酸和甘油 | |
| B. | 防腐剂都有一定的毒性,所以不能吃含防腐剂的食品 | |
| C. | 蛋白质溶液、淀粉溶液都属胶体 | |
| D. | 玻璃钢是新型的无机非金属材料 |
1.钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).
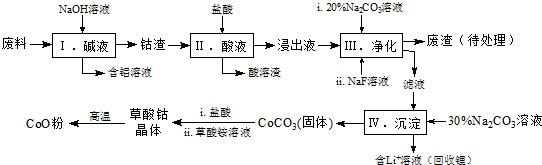
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表.
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O.
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15;废渣中的主要成分除了LiF外,还有Fe(OH)3.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是降低滤液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀.
(5)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
①加热到210℃时,固体质量减轻的原因是失去结晶水.
②经测定,加热到210~290℃过程中的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为:3CoC2O4+2O2 Co3O4+6CO2.[已知M(CoC2O4•2H2O)=183g/mol].
Co3O4+6CO2.[已知M(CoC2O4•2H2O)=183g/mol].

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表.
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O.
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15;废渣中的主要成分除了LiF外,还有Fe(OH)3.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是降低滤液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀.
(5)在空气中加热5.49g草酸钴晶体(CoC2O4•2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表.
| 温度范围/℃ | 固体质量/g |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
②经测定,加热到210~290℃过程中的生成物只有CO2和钴的氧化物,此过程发生反应的化学方程式为:3CoC2O4+2O2
 Co3O4+6CO2.[已知M(CoC2O4•2H2O)=183g/mol].
Co3O4+6CO2.[已知M(CoC2O4•2H2O)=183g/mol].
8.常温下,下列溶液中说法正确的是( )
| A. | 0.2mol•L-1氨水中滴入0.2mol•L-1CH3COOH溶液可能存在:c(NH4+)-(CH3COO-)>c(OH-)-c(H+) | |
| B. | pH=5.6的NaHSO3溶液:c(Na+)>c(HSO3-)>c(H2SO3)>c(SO32-) | |
| C. | 向BaSO4悬浊液中加入Na2SO4固体,Ksp(BaSO4)变小 | |
| D. | 若pOH=-lgc(OH-),则pH=3的盐酸与pOH=3的氨水等体积混合溶液,PH>7 |
18.下列解释实验现象的方程式不正确的是( )
| A. | 向盛有少量Mg(OH)2沉淀的试管中滴加适量NH4Cl溶液,沉淀溶解:Mg(OH)2+2NH4+═2NH3•H2O+Mg2+ | |
| B. | SO2通入澄清石灰水中,产生白色沉淀:SO2+Ca2++2OH-═CaSO4↓+H2O | |
| C. | 向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++2 HCO3-+2 OH-═CaCO3↓+CO32-+2H2O | |
| D. | 长期过量服用阿司匹林出现水杨酸(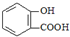 )反应,可静脉注滴NaHCO3溶液: )反应,可静脉注滴NaHCO3溶液: |
5.下列指定反应的离子方程式正确的是( )
| A. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ | |
| B. | NH4Al(SO4)2溶液与过量稀氨水反应:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| C. | 用稀硝酸清洗试管内壁的银镜:Ag+2H++NO3-=Ag++NO2↑+H2O | |
| D. | FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
2.下列关于苯的叙述中错误的是( )
| A. | 苯在催化剂作用下能与液溴发生取代反应 | |
| B. | 在苯中加入酸性KMnO4溶液,振荡并静置后下层液体为紫色 | |
| C. | 在苯中加入溴水,振荡并静置后下层液体为橙色 | |
| D. | 在一定条件下,苯能与氢气发生加成反应 |
18.下列示意图与对应的反应情况正确的是( )
| A. | 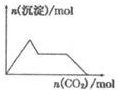 含0.0l mol KOH和0.01 mol Ca(OH)2的混合溶液中缓慢通入CO2 | |
| B. | 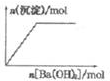 NaHSO4溶液中逐滴加入Ba(OH)2溶液 | |
| C. | 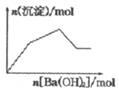 KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液 | |
| D. | 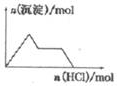 NaAlO2溶液中逐滴加入盐酸 |