题目内容
3.在密闭容器中进行反应:X(g)+3Y(g)?2Z(g),有关下列图象的说法不正确的是( )| A. | 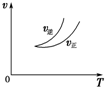 可判断正反应为放热反应 | |
| B. | 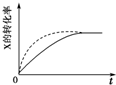 虚线表示可能使用了催化剂或是加压 | |
| C. | 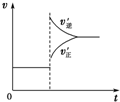 若正反应的△H<0,可表示升高温度使平衡向逆反应方向移动 | |
| D. | 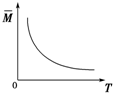 气体平均相对分子质量随温度变化情况,可推知正反应的△H>0 |
分析 A、依据图象分析,温度升高逆反应速率大于正反应速率,平衡逆向进行,逆向是吸热反应;
B、压强增大改变反应速率增大,缩短反应达到平衡的时间,化学平衡向正反应方向移动;
C、若正反应的△H<0,是放热反应升温平衡逆向进行,逆反应速率大于正反应速率;
D、图象分析,温度升高平均相对分子质量减小,平均分子质量减小,总质量不变,说明气体物质的量变大,所以平衡逆向进行,逆反应是吸热反应,正反应是放热反应.
解答 解:A、依据图象分析,温度升高逆反应速率大于正反应速率,平衡逆向进行,逆向是吸热反应,正向是放热反应,故A正确;
B、压强增大改变反应速率增大,缩短反应达到平衡的时间,化学平衡向正反应方向移动,图象不符合平衡移动,故B错误;
C、若正反应的△H<0,是放热反应升温平衡逆向进行,逆反应速率大于正反应速率,图象符合反应速率的变化,故C正确;
D、图象分析,温度升高平均相对分子质量减小,平均分子质量减小,总质量不变,说明气体物质的量变大,所以平衡逆向进行,逆反应是吸热反应,正反应是放热反应△H<0,故D错误;
故选BD.
点评 本题考查化学平衡的建立和影响因素的分析判断,图象分析判断是解题关键,题目难度中等.

练习册系列答案
相关题目
18.下列解释实验现象的方程式不正确的是( )
| A. | 向盛有少量Mg(OH)2沉淀的试管中滴加适量NH4Cl溶液,沉淀溶解:Mg(OH)2+2NH4+═2NH3•H2O+Mg2+ | |
| B. | SO2通入澄清石灰水中,产生白色沉淀:SO2+Ca2++2OH-═CaSO4↓+H2O | |
| C. | 向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++2 HCO3-+2 OH-═CaCO3↓+CO32-+2H2O | |
| D. | 长期过量服用阿司匹林出现水杨酸(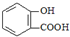 )反应,可静脉注滴NaHCO3溶液: )反应,可静脉注滴NaHCO3溶液: |
14.下列有机物分子中,所有碳原子不可能处于同一平面的是( )
| A. | 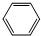 | B. | HC≡C-CH3 | C. |  | D. | 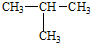 |
11.下列各组物质中,互为同分异构体的是( )
| A. | ${\;}_{1}^{2}$H和${\;}_{1}^{3}$H | B. | H2O和H2O2 | ||
| C. | CH4和CH3CH3 | D. | 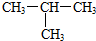 和CH3-CH2-CH2-CH3 和CH3-CH2-CH2-CH3 |
18.下列示意图与对应的反应情况正确的是( )
| A. | 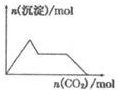 含0.0l mol KOH和0.01 mol Ca(OH)2的混合溶液中缓慢通入CO2 | |
| B. | 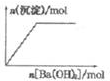 NaHSO4溶液中逐滴加入Ba(OH)2溶液 | |
| C. | 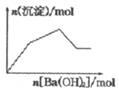 KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液 | |
| D. | 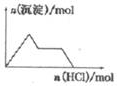 NaAlO2溶液中逐滴加入盐酸 |
8.下列互为同素异形体的是( )
| A. | T与D | B. | 40K与40Ca | C. | 金刚石与石墨 | D. | 正丁烷与异丁烷 |
15.下列变化过程中,共价键被破坏的是( )
| A. | 碘升华 | B. | 二氧化碳变成干冰 | ||
| C. | 氯化氢气体溶于水 | D. | 碘溶于酒精 |
12.短周期的A、B、C、D、E五种元素,原子序数依次增大.已知元素A的简单气态氢化物和它的最高价氧化物的水化物反应生成盐;B、E为同主族元素,且B元素原子最外层电子数是次外层的3倍; C是短周期中与水反应最激烈的金属元素;A、D最外层电子数相差2.下列说法错误的是( )
| A. | 原子半径:A>B | |
| B. | 失电子的能力:C<D | |
| C. | 简单气态氢化物的稳定性:B>E | |
| D. | 元素C、D、E的最高价氧化物对应的水化物两两之间能发生反应 |
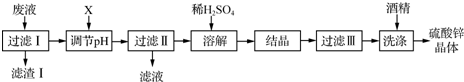
13. 实验室用粗锌(含铅等杂质)与过量的稀硫酸反应制氢气的废液制备硫酸锌晶体,其流程如下:
实验室用粗锌(含铅等杂质)与过量的稀硫酸反应制氢气的废液制备硫酸锌晶体,其流程如下:
已知ZnSO4的溶解度如下表所示:
(1)实验过程中多次用到如图所示的过滤装置,仪器a的名称为抽滤瓶.
(2)滤渣Ⅰ的主要成分为PbSO4.X的化学式为ZnO或Zn(OH)2.
(3)溶解过程中加入的稀硫酸的作用是制备ZnSO4并抑制ZnSO4水解.
(4)结晶的操作为蒸发浓缩、冷却结晶.
(5)用酒精进行洗涤的原因是减少硫酸锌晶体的损失,容易干燥.
 实验室用粗锌(含铅等杂质)与过量的稀硫酸反应制氢气的废液制备硫酸锌晶体,其流程如下:
实验室用粗锌(含铅等杂质)与过量的稀硫酸反应制氢气的废液制备硫酸锌晶体,其流程如下:
已知ZnSO4的溶解度如下表所示:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.6 | 47.5 | 53.8 | 61.3 | 70.5 | 75.4 | 71.1 | 60.5 |
(2)滤渣Ⅰ的主要成分为PbSO4.X的化学式为ZnO或Zn(OH)2.
(3)溶解过程中加入的稀硫酸的作用是制备ZnSO4并抑制ZnSO4水解.
(4)结晶的操作为蒸发浓缩、冷却结晶.
(5)用酒精进行洗涤的原因是减少硫酸锌晶体的损失,容易干燥.