题目内容
15.填写分离下列各混合物所用的主要操作方法.(1)除去硝酸钾中混有的少量氯化钠用溶解、降温结晶、过滤;
(2)除去氯化钠中混有的少量硝酸钾用蒸发浓缩、趁热过滤.
分析 (1)硝酸钾、氯化钠的溶解度受温度影响不同;
(2)温度高,硝酸钾的溶解度大,而NaCl的溶解度小.
解答 解(1)硝酸钾固体的溶解度随温度的升高明显增大,氯化钠固体的溶解度受温度变化影响较小,如提纯硝酸钾,就要让它成为晶体析出,所以先溶解,然后用降温结晶的方法,然后过滤得到硝酸钾,
故答案是:溶解、降温结晶、过滤;
(2)除去氯化钠中混有的少量硝酸钾用溶解、蒸发浓缩、趁热过滤可得到NaCl,硝酸钾在滤液中,故答案为:溶解、蒸发浓缩、趁热过滤.
点评 本题考查物质的分离提纯方法和选择,为高频考点,把握物质的性质、溶解度受温度的影响差异为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
5.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 78g苯含有C=C键的数目为3NA | |
| B. | 室温时,8g SO3分子中氧原子的数目为0.3NA | |
| C. | 在反应中KClO4+8HCl=KCl+4Cl2↑+4H2O,每生成4molCl2转移的电子数目为8NA | |
| D. | 1molFeCl2与足量氯气反应时转移的电子数为2NA |
6.将1mol过氧化钠与2mol碳酸氢钠固体混合,在密闭容器中,120℃充分反应后,排出气体,冷却,有固体残留.下列分析正确的是( )
| A. | 残留固体是2mol Na2CO3 | |
| B. | 残留固体是 Na2CO3和NaOH的混合物 | |
| C. | 反应中转移2mol电子 | |
| D. | 排出的气体是1.5mol氧气 |
10.下列说法中,不正确的是( )
| A. | H、D、T互为同位素 | |
| B. | NaHCO3、HCOONa均含有离子键和共价键 | |
| C. | 常温常压下,22.4 L CCl4含有NA个CCl4分子 | |
| D. | 常温下,23 g NO2含有NA个氧原子 |
4.如图图示与对应的叙述不相符的是( )


| A. | 图1的目的是检验装置的气密性 | |
| B. | 图2中分液漏斗振荡静置后,上层液体颜色变浅 | |
| C. | 图3中电流计的指针不发生偏转 | |
| D. | 图4液态水分解的热化学方程式为:2H2O(1)═2H2(g)+O2(g)△H=+571.6KJ/mol |
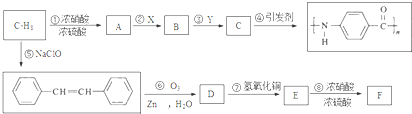
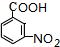 .A~E中互为同分异构体的还有
.A~E中互为同分异构体的还有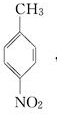 和
和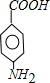 .(填结构简式)
.(填结构简式)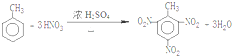 .
.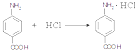 .
.

 (立方烷)
(立方烷) (环辛四烯)
(环辛四烯)