题目内容
10.下列说法中,不正确的是( )| A. | H、D、T互为同位素 | |
| B. | NaHCO3、HCOONa均含有离子键和共价键 | |
| C. | 常温常压下,22.4 L CCl4含有NA个CCl4分子 | |
| D. | 常温下,23 g NO2含有NA个氧原子 |
分析 A、同一种元素的不同原子互称同位素;
B、离子键一般形成于活泼的金属和非金属元素之间,共价键一般形成于非金属元素之间;
C、四氯化碳为液态;
D、求出二氧化氮的物质的量,然后根据1mol二氧化氮中含2mol氧原子来分析.
解答 解:A、同一种元素的不同原子互称同位素,而H、D、T是氢元素的三种不同的氢原子,故互为同位素,故A正确;
B、离子键一般形成于活泼的金属和非金属元素之间,共价键一般形成于非金属元素之间,故NaHCO3、HCOONa均含有离子键和共价键,故B正确;
C、四氯化碳为液态,不能根据气体摩尔体积来计算其物质的量,故C错误;
D、23g二氧化氮的物质的量为0.5mol,而1mol二氧化氮中含2mol氧原子,故含有的氧原子的物质的量为1mol,即含NA个氧原子,故D正确.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算和离子键、共价键的存在,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.实验室可用浓盐酸与浓硫酸混合快速制取HCl.下列解释合理的是( )
| A. | 浓硫酸是高沸点的酸,通过它与浓盐酸反应制取低沸点的酸 | |
| B. | 通过改变温度和浓度等条件,利用平衡移动原理制取HCl | |
| C. | 两种强酸混合,溶解度会相互影响,低溶解度的物质析出 | |
| D. | 浓硫酸的浓度远大于浓盐酸的浓度,高浓度的酸制取低浓度的酸 |
18.用如图示的方法可以保护钢质闸门.下列说法正确的是( )


| A. | 当a、b间用导体连接时,则X应发生氧化反应 | |
| B. | 当a、b间用导体连接时,则X可以是锌或石墨 | |
| C. | 当a、b与外接电源相连时,a应连接电源的正极 | |
| D. | 当a、b与外接电源相连时,阴极的电极反应式:2Cl--2e→Cl2↑ |
5.2014年全国多个城市出现了严重的雾霾天气,十面“霾”伏,自强不“吸”等网络语流行,( )
| A. | 目前加碘食盐中主要添加的是KI | |
| B. | 光化学烟雾与大量排放碳氢化合物和氮氧化合物有关 | |
| C. | 淀粉、纤维素和聚乙烯都属于天然高分子化合物 | |
| D. | 光纤通信使用的光缆的主要成分和太阳能电池使用的材料都是SiO2 |
2.下列措施对增大化学反应速率明显增大的是( )
| A. | 使用催化剂 | B. | 增加压强 | C. | 增大反应物浓度 | D. | 升高温度 |
19.设NA代表阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1.00 mol•L-1 NaCl溶液中含有Na+的数目为NA | |
| B. | 常温常压下,6.4 g由氧气和臭氧组成的混合物中含有的分子总数为0.2NA | |
| C. | 标准状况下,1.12 L HCHO中C原子的数目为0.05 NA | |
| D. | 在催化剂作用下,6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2NA |
4.利用下列实验器材(规格和数量不限)不能完成相应实验的一项是( )
| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 烧杯、玻璃棒、坩埚、坩埚钳、酒精灯、三脚架 | 灼烧FeCl3固体 |
| B | 烧杯、玻璃棒、胶头滴管、漏斗、滤纸、带铁圈的铁架台 | 用NaOH溶液除去Fe粉中少量Al |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶、量筒 | 用10mol•L-1的硫酸配置0.1mol•L-1的硫酸 |
| D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
| A. | A | B. | B | C. | C | D. | D |
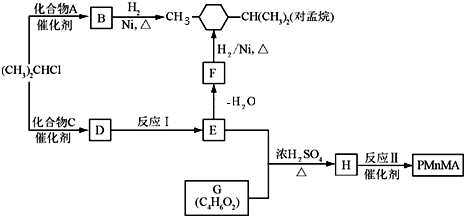

 .
.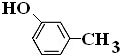 .
. .
.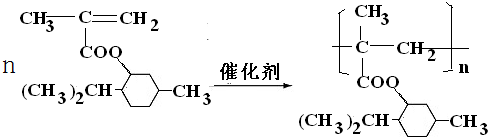 .
.