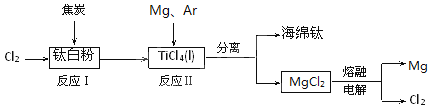
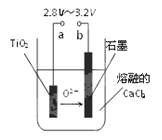
��Ŀ����
����Ŀ���о�CO2�����öԴٽ���̼���Ĺ���������Ҫ���塣
��1����CO2�뽹̿��������CO��CO�����������ȡ�
��֪����Fe2O3(s) + 3C(ʯī) = 2Fe(s) + 3CO(g) ��H 1 = +489.0 kJ��mol��1
��C(ʯī) +CO2(g) = 2CO(g) ��H 2 = +172.5 kJ��mol��1
��CO��ԭFe2O3(s)���Ȼ�ѧ����ʽΪ ��
��2��������̼�ϳɼ״���̼���ŵ��·���CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ��
CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g) ��H
CH3OH(g) +H2O(g) ��H
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪK= ��
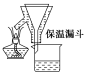
��ȡһ�����CO2��H2�Ļ�����壨���ʵ���֮��Ϊ1��3������������ܱ�������������������Ӧ����Ӧ�����в�ü״������������(CH3OH)�뷴Ӧ�¶�T�Ĺ�ϵ��ͼ1��ʾ����÷�Ӧ�Ħ�H 0���>������<����������
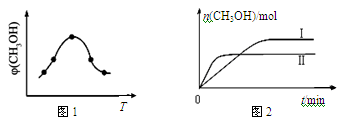
�������ֲ�ͬ�����·�����Ӧ�����CH3OH�����ʵ�����ʱ��仯��ͼ2��ʾ�����ߢ��Ӧ��ƽ�ⳣ����С��ϵΪK�� K��(�>������<������)���жϵ����� ��
��3����CO2Ϊԭ�ϻ����Ժϳɶ������ʡ�
�ٹ�ҵ������[CO(NH2)2]��CO2��NH3��һ�������ºϳɣ�����Ӧ����ʽΪ ����ʼ����̼��=3���з�Ӧ����ƽ��ʱCO2��ת����Ϊ60������NH3��ƽ��ת����Ϊ ��
��������CO2ͨ�뱥�Ͱ�ˮ�пɵõ���NH4HCO3����֪������һˮ�ϰ�Kb=1.8��10��5��̼��һ�����볣��Kb=4.3��10��7����NH4HCO3��Һ�� ������ԡ��������ԡ��������ԡ�����
���𰸡���1��Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) ��H = ��28.5 kJ��mol��1��
��2����![]() ���ڣ��� �ۣ������ȵ���ƽ����˵�������¶ȸ����������˷�Ӧ�������Ƿ��ȷ�Ӧ�������¶�ƽ��������K��>K����
���ڣ��� �ۣ������ȵ���ƽ����˵�������¶ȸ����������˷�Ӧ�������Ƿ��ȷ�Ӧ�������¶�ƽ��������K��>K����
��3����2NH3+CO2![]() CO(NH2)2+H2O��40% ��
CO(NH2)2+H2O��40% ��
��������
���������
��1���٣��ڡ�3�ã�3CO(g)��Fe2O3(s)=2Fe(s)��3CO2(g) ��H=��H1��3����H2= ��28.5 kJ��mol��1����������Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) ��H = ��28.5 kJ��mol��1��
��2����ƽ�ⳣ�����ﵽ��ѧƽ��ʱ��������Ũ�ȵ���֮���뷴Ӧ��Ũ�ȵ���֮����K=c(CH3OH)��c(H2O)/[c(CO2)��c3(H2)]��
���о���ߵ��Ժ�������¶�������CH3OH�����������С��������������ԭ���������¶���ƽ�����淴Ӧ�������������H<O��
�ۢ��ȵ���ƽ����˵�������¶ȸ����������˷�Ӧ�������Ƿ��ȷ�Ӧ�������¶�ƽ��������K��>K����
��3���ٸ��ݷ�Ӧǰ��ԭ�Ӹ�����Ԫ���غ��֪��Ӧ����ʽ��CO2��2NH3![]() CO(NH2)2+H2O����CO2�ij�ʼ���ʵ���Ϊa����NH3�ij�ʼ���ʵ���Ϊ3a����CO2��ת����Ϊ60%����ת���Ķ�����̼Ϊa��60%=0.6a�����ݷ���ʽ��֪��ת����NH3�����ʵ���Ϊ0.6a��2=1.2a����ƽ��ʱ������ת���ʶ�Ϊ1.2a��3a=40%�����ݵ��볣����֪HCO3��ˮ��ǿ��NH4��ˮ�⣬���������ԡ�
CO(NH2)2+H2O����CO2�ij�ʼ���ʵ���Ϊa����NH3�ij�ʼ���ʵ���Ϊ3a����CO2��ת����Ϊ60%����ת���Ķ�����̼Ϊa��60%=0.6a�����ݷ���ʽ��֪��ת����NH3�����ʵ���Ϊ0.6a��2=1.2a����ƽ��ʱ������ת���ʶ�Ϊ1.2a��3a=40%�����ݵ��볣����֪HCO3��ˮ��ǿ��NH4��ˮ�⣬���������ԡ�

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ����Fe3�����������ԣ�ʵ���Ҳⶨ�����Һ��I�����������������£���ȡ25.00 mL��Һ��250 mL��ƿ�У��ֱ����5 mL 2 mol��L��1 H2SO4��10 mL 20% Fe2(SO4)3��Һ��ҡ����С���������������ȫ������ȡ����ƿ��ȴ���뼸�ζ����������ƣ�����ָʾ��������0.02500 mol��L��1��K2Cr2O7��Һ���еζ����յ㡣�ظ�3�Σ����ݼ�¼���±���
���� | 1 | 2 | 3 |
����/mL | 19.98 | 20.02 | 19.00 |
��1����ʢ�з�Һ����ƿ���ȼ���5 mL 2 mol��L��1 H2SO4��Ŀ����
______________________________���������ӷ���ʽ�������������ͣ�
��2�������������漰�ķ�Ӧ����2Fe3����2I��===2Fe2����I2 ��______________________________��
��3�����ݵζ��й����ݣ��÷�Һ��I��������_____g��L��1��
��4���ڵζ������У����в���������������ȷ������ɲⶨ���ƫ�͵���___________��
A���յ����ʱ���Ӷ������ζ�ǰƽ�Ӷ���
B����ƿˮϴ�º�δ����
C���ζ���δ�ñ�K2Cr2O7��Һ��ϴ
D��ʢ��K2Cr2O7��Һ�ĵζ��ܣ��ζ�ǰ�����ݣ��ζ���������
��Fe3����Ag�������������ǿ��һֱ��ʵ��̽�����ȵ㡣ijѧϰС��ͬѧ�������ʵ�飺
ʵ���� | ʵ����� | ���� |
1 | ��10mL 3mol/L KNO3������Һ��pH=1���в���һ���ྻ��Ag˿�����μ�NaCl��Һ | �ް�ɫ�������� |
2 | ��10mL 1mol/L AgNO3��Һ�еμ�2mL 0.1mol/L FeSO4��Һ�����ٵμ�����KMnO4��Һ | �Ϻ�ɫ����ȥ |
3 | ��10mL 1mol/L Fe(NO3)3������Һ��pH=1���в���һ���ྻ��Ag˿�����μ�NaCl��Һ | �а�ɫ�������� |
��ش�
��5�����ʵ��ٵ�Ŀ����______________________________��
��6��ʵ��ۿɵó�������______________________________��
��7��д��ʵ����з�Ӧ�����ӷ���ʽ______________________________��
��8����������ʵ�飬Fe3����Ag�������������ǿ��������____________________�йء�