题目内容
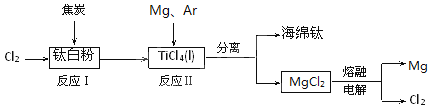
【题目】21世纪是钛的世纪。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程:
已知:
① Mg(s)+Cl2 (g)=MgCl2 (s) △H=-641 kJ·mol-1
② Cl2(g)+1/2Ti (s)=1/2TiCl4 (l) △H=-385 kJ·mol-1
(1)反应Ⅰ在800~900℃下进行,还生成一种可燃性无色气体,
该反应的化学方程式为 。
(2)反应Ⅱ的热化学方程式为 。
(3)反应Ⅱ中充入气体Ar的原因是 。
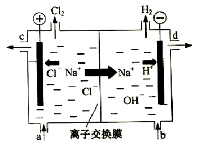
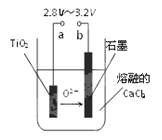
(4)在800℃~1000℃时电解TiO2也可制得海绵钛,装置如右上图所示。
图中b是电源的 极,阴极的电极反应式为 。
【答案】(1)2Cl2+2C+TiO2 = TiCl4+2CO
(2)2Mg(s)+TiCl4 (l)=Ti (s) + 2MgCl2 (s) △H=-512 kJ·mol-1
(3)作保护气,防止金属被氧化 (4)正, TiO2 + 4e- = Ti + 2O2-
【解析】
试题分析:(1)反应Ⅰ是氯气和钛白粉、焦炭反应生成钛和一种可燃性无色气体,依据原子守恒可知气体为一氧化碳,反应的化学方程式为:2Cl2+2C+TiO2 = TiCl4+2CO;
(2)① Mg(s)+Cl2 (g)=MgCl2 (s) △H=-641 kJ·mol-1
② Cl2(g)+1/2Ti (s)=1/2TiCl4 (l) △H=-385 kJ·mol-1
根据盖斯定律①×2-②×2,得2Mg(s)+TiCl4 (l)=Ti (s) + 2MgCl2 (s) △H=-512 kJ·mol-1;
(3)反应Ⅱ充入氩气作保护气,防止金属被氧化;
(4)电解池的阳极是氧离子发生失电子的氧化反应,导致氧气等气体的出现,所以电极反应式为: 2O2-=O2↑+4e-,则b是电源的正极,电解池的阴极发生得电子的还原反应,是二氧化钛电极本身得电子的过程,即TiO2 + 4e- = Ti + 2O2-。