题目内容
【题目】Ⅰ:硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。为测定补血剂中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一 滴定法 用酸性KMnO4溶液滴定测定铁元素的含量。
反应原理:5Fe2++MnO+8H+===5Fe3++Mn2++4H2O
(1)实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需_________________(填仪器名称)。
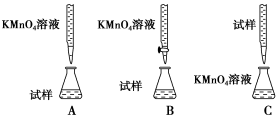
(2)某同学设计的下列滴定方式中,最合理的是___________(夹持部分略去)(填字母序号)。
方案二 重量法 操作流程如下:

(3)若省略步骤②,则加入过量X溶液后会产生白色沉淀,请写出该沉淀在空气中变质的方程式:______________________________________________。
(4)步骤④中一系列操作依次是:过滤、洗涤、灼烧、冷却、称量。
II:六水合硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,易溶于水,不溶于酒精,在水中的溶解度比FeSO4或(NH4)2SO4都要小。实验室中常以废铁屑为原料来制备,其步骤如下:
图1 图2
图2
步骤1:铁屑的处理。将废铁屑放入热的碳酸钠溶液中浸泡几分钟后,用图1所示的倾析方法分离出固体并洗涤、干燥。
步骤2:FeSO4溶液的制备。向锥形瓶中加入30mL的3 mol·L-1H2SO4溶液,再加入过量的铁屑,加热至充分反应为止。趁热过滤(如图2所示),收集滤液和洗涤液。
步骤3:六水合硫酸亚铁铵的制备。向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,所得溶液经过一系列操作、洗涤后得到六水合硫酸亚铁铵晶体。
请回答下列问题:
(1)趁热过滤的目的和理由是________________________________________________。
(2) ①步骤3中的一系列操作包括:_________________________________。
②洗涤硫酸亚铁铵晶体最好用什么试剂:_________________________________。
【答案】Ⅰ:(1) 250mL容量瓶
(2) B
(3) 4Fe(OH)2+O2+2H2O=4Fe(OH)3
II:(1)过滤掉混合物中的铁屑,减少溶质硫酸亚铁铵的损失。
(2)蒸发浓缩 冷却结晶 过滤 乙醇
【解析】
试题分析:Ⅰ、(1)精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶,即还缺少250mL容量瓶;
(2)酸性溶液或强氧化性溶液应用酸式滴定管,即应该用酸式滴定管盛放酸性高锰酸钾溶液,答案选B;
(3)由流程图可知,该实验原理为:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量;其中氢氧化亚铁易被氧化为氢氧化铁,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;
II、(1)溶液趁热过滤是为了防止溶液冷却时,硫酸亚铁因析出而损失,即趁热过滤的目的和理由是过滤掉混合物中的铁屑,减少溶质硫酸亚铁铵的损失。
(2)加入(NH4)2SO4固体后,溶液表面出现晶膜时,停止加热,采取蒸发浓缩、冷却结晶方法,因此从溶液中获得晶体的操作即①步骤3中的一系列操作包括蒸发浓缩、冷却结晶、过滤;
(3)由于硫酸亚铁铵晶体不溶于乙醇,所以可以用乙醇洗去晶体表面的水。

 阅读快车系列答案
阅读快车系列答案