题目内容
【题目】下表是某兴趣小组通过实验获得的相同体积足量稀硫酸与铁反应的实验数据:
实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4) mol/L | 实验 温度/℃ | 金属消失 的时间/s |
1 | 0.10 | 丝 | 0.7 | 20 | 250 |
2 | 0.10 | 丝 | 1.0 | 20 | 200 |
3 | 0.10 | 粉末 | 1.0 | 20 | 125 |
4 | 0.10 | 粉末 | 1.0 | 30 | 50 |
分析上述数据,回答下列问题:
(1)反应的离子方程式: ;
(2)①实验1、2可得出的结论是,硫酸浓度越 ,反应速率越慢;
②实验2、3可得出的结论是反应物接触面越大,反应速率越 ;
③实验3、4可得出的结论是温度越 ,反应速率越快。
(3)①用铁粉和稀硫酸反应制取H2,实验过程中绘制出生成H2的体积(V)与时间(t)的关系如图所示。 试分析判断OE段、EF段、FG段、GH段反应速率(分别用v (OE)、v (EF)、v (FG)、 (GH)表示)最快时段是 。
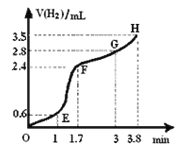
A.v (OE) B.v (EF) C.v (FG) D.v (GH)
②1min内反应较慢的原因是: ;
一段时间后反应明显加快的原因是 。
【答案】(1)Fe+2H+=Fe2++H2↑
(2)①稀 ;②快;③高 (3)①B②温度较低 、反应放热,使溶液的温度升高
【解析】
试题分析:(1)反应的离子方程式为Fe+2H+=Fe2++H2↑;
(2)①实验1、2中只有浓度是变化量,可得出的结论是,硫酸浓度越稀,反应速率越慢;
②实验2、3中金属的状态不同,可得出的结论是反应物接触面越大,反应速率越快;
③实验3、4中温度是变量,可得出的结论是温度越高,反应速率越快;
(3)①EF段斜率最大,说明反应速率最快;
②1min内反应较慢的原因是温度较低;该反应放热,使溶液的温度升高,所以一段时间后反应明显加快。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目