题目内容
14. 原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.
原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为sp,1mol Y2X2含有σ键的数目为3NA.
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是氨气中存在氢键、甲烷中不存在氢键.
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是N2O.
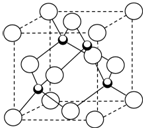
(4)元素W的一种氯化物晶体的晶胞结构如上图所示,该氯化物的化学式是CuCl,它可与浓盐酸发生非氧化还原反应,生成配合物HnWCl3,反应的化学方程式为CuCl+2HCl=H2CuCl3或CuCl+2HCl=H2[CuCl3].
分析 原子序数小于36的X、Y、Z、W四种元素,其中X是周期表中半径最小的元素,则X是H元素;
Y原子基态时最外层电子数是其内层电子数的2倍,原子最外层电子数不超过8个,所以其内层为K层,则Y是C元素;
Z原子基态时2p原子轨道上有3个未成对的电子,则Z是N元素;
W的原子序数为29,则W是Cu元素,再结合物质结构分析解答.
解答 解:原子序数小于36的X、Y、Z、W四种元素,其中X是周期表中半径最小的元素,则X是H元素;
Y原子基态时最外层电子数是其内层电子数的2倍,原子最外层电子数不超过8个,所以其内层为K层,则Y是C元素;
Z原子基态时2p原子轨道上有3个未成对的电子,则Z是N元素;
W的原子序数为29,则W是Cu元素,
(1)C2H2分子中每个C原子含有2个σ键,所以C轨道的杂化类型为sp杂化,一个乙炔分子中含有3个σ键,则1mol C2H2含有σ键的数目为3NA,
故答案为:sp;3NA;
(2)氨气中存在氢键,甲烷中不存在氢键,氢键的存在导致氨气的沸点升高,所以化合物NH3的沸点比化合物CH4的高,
故答案为:氨气中存在氢键、甲烷中不存在氢键;
(3)元素C的一种氧化物与元素N的一种氧化物互为等电子体,CO2和N2O互为等电子体,所以元素Z的这种氧化物的分子式是N2O,
故答案为:N2O;
(4)该晶胞中黑色球个数=4,白色球个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以黑色球和白色球个数之比=4:4=1:1,所以该氯化物的化学式为CuCl,它可与浓盐酸发生非氧化还原反应,生成配合物H2CuCl3,反应的化学方程式为 CuCl+2HCl=H2CuCl3或CuCl+2HCl=H2[CuCl3],
故答案为:CuCl; CuCl+2HCl=H2CuCl3或CuCl+2HCl=H2[CuCl3].
点评 本题考查了元素位置结构性质的相互关系及应用,涉及晶胞的计算、氢键、原子杂化方式的判断等知识点,这些知识点都是考试热点,灵活运用基本知识来分析解答,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | NaHS水解:HS-+H2O?S2-+H3O+ | |
| B. | 向硫酸铁溶液中加入铁:Fe3++Fe═2Fe2+ | |
| C. | 在铁上镀铜阳极反应为:Cu2++2e-═Cu | |
| D. | 氯化铜水解:Cu2++2H2O?Cu(OH)2+2H+ |
| A. | 一定条件下,Cl2 可在甲苯的苯环或侧链上发生取代反应? | |
| B. | 苯酚钠溶液中通入CO2 生成苯酚,则碳酸的酸性比苯酚弱? | |
| C. | 乙烷和丙烯混合气体的物质的量共1 mol,完全燃烧生成3 mol H2O | |
| D. | 光照下,2,2-二甲基丙烷与Br2 反应其一溴取代物只有一种 |
 X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )
X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )| A. | 化合物XZ3中各原子均满足8电子的稳定结构 | |
| B. | X,Y,Z三种元素形成的含氧酸都是强酸 | |
| C. | 常温下,Z单质可与Y的氢化物发生置换反应 | |
| D. | X3-与Al3+有相同的电子数,前者只有氧化性,后者只有还原性 |
| A. | 稀硫酸与氢氧化钡溶液反应:Ba2-+SO42-═BaSO4↓ | |
| B. | 氧化铜与稀硫酸混合:CuO+2H+═Cu2++H2O | |
| C. | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+OH-═Cu(OH)2↓+SO42- | |
| D. | 氯化铝溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
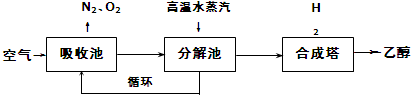
吸收池中盛有饱和碳酸钾溶液,把含有二氧化碳的空气吹入吸收池中,吸收池中反应液进入分解池后,向分解池中通入高温水蒸汽,把二氧化碳从溶液中提取出来,在合成塔中和氢气经化学反应使之变为可再生燃料乙醇.回答下列问题:
(1)写出吸收池中反应的离子方程式CO2+CO32-+H2O=2HCO3-.
(2)从分解池中循环使用的物质是K2CO3.
(3)在一定压强下,测得由CO2制取CH3CH2OH的实验数据如表:
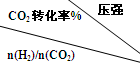 | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
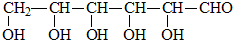 B.CH3CH2OH
B.CH3CH2OH 乳酸 D.
乳酸 D.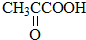 丙酮酸
丙酮酸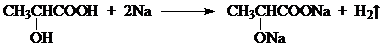 .
.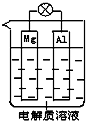 一种原电池的组成如图所示.试回答下列问题(灯泡功率合适):
一种原电池的组成如图所示.试回答下列问题(灯泡功率合适):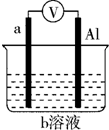 如图是某同学设计的一个简易的原电池装置,回答下列问题.
如图是某同学设计的一个简易的原电池装置,回答下列问题.