题目内容
17.随着卤素原子半径的增加,下列递变规律正确的是( )| A. | 单质的熔沸点逐渐降低 | B. | 卤素离子的还原性逐渐增强 | ||
| C. | 最高正化合价逐渐增大 | D. | 单质的氧化性逐渐增强 |
分析 A.卤素单质都是分子晶体,其熔沸点随着相对分子质量增大而增大;
B.卤单质氧化性越强,对应离子的还原越弱;
C.主族元素中,其最高正化合价与其族序数相等,但O、F元素没有正化合价;
D.元素的非金属性越强,其单质的氧化性越强.
解答 解:A.卤素单质都是分子晶体,其熔沸点随着相对分子质量增大而增大,卤族元素中随着原子序数增大其分子的相对分子质量增大,所以其熔沸点逐渐升高,故A错误;
B.卤族元素中,随着原子序数增大元素非金属性逐渐减弱,所以其单质的氧化性逐渐减弱,所以卤素离子的还原性逐渐增强,故B正确;
C.主族元素中,其最高正化合价与其族序数相等,但O、F元素没有正化合价,卤族元素中其最高正化合价都是+7(F元素除外),故C错误;
D.元素的非金属性越强,其单质的氧化性越强,卤族元素中,随着原子序数增大元素非金属性逐渐减弱,所以其单质的氧化性逐渐减弱,故D错误;
故选B.
点评 本题考查同一主族元素性质递变规律,为高考高频点,熟练掌握碱金属族、卤族元素及第三周期元素原子结构及其性质递变规律,注意规律中的特殊现象,易错选项是C.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.铊元素位于元素周期表第6周期ⅢA族.下面关于铊元素性质的说法不正确的是( )
| A. | 氢氧化铊是两性氢氧化物 | |
| B. | 在化合物中呈+3价 | |
| C. | 单质铊与同浓度的盐酸反应比铝剧烈 | |
| D. | 铊的还原性比铝的强 |
8.金属及塑料制品表面镀铬不仅美观还可提高金属制品抗腐蚀性能,电镀废水中六价铬具有高毒性,必须经处理后才能排放.
(1)常见镀铬液由重铬酸(H2Cr2O7)和催化剂硫酸组成.
①镀铬液在水溶液中存在如下平衡:Cr2O72-+H2O?2CrO42-+2H+该反应平衡常数表达式为K=$\frac{{c}^{2}(Cr{O}_{4}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{O}_{7}^{2-})}$.
②镀铬时由CrO42-放电产生铬镀层.阴极的电极反应式为CrO42-+8H++6e-=Cr+4H2O.
③ABS塑料表面经处理后也可在其表面镀铬,ABS塑料的结构简式如下:
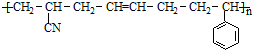 ,合成该聚合物的三种单体为:CH2=CHCN、CH2=CH-CH=CH2和
,合成该聚合物的三种单体为:CH2=CHCN、CH2=CH-CH=CH2和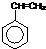 (写结构简式).
(写结构简式).
(2)工业上处理含铬废水有钡盐法、电解还原法等.
Ⅰ.钡盐法处理含铬废水主要流程为:
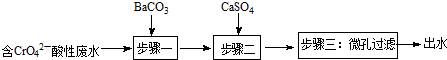
已知:
①步骤一发生的反应之一为:CrO42-+BaCO3═BaCrO4+CO32-,可推知:Ksp(BaCrO4)<Ksp(BaCO3)(选填:“>”或“<”);
②步骤二的目的是除去废水中Ba2+.
Ⅱ.电解法处理含六价铬(Cr2O72-和CrO42-)的强酸性废水,其原理如图所示.

③电解一段时间后随着溶液pH的升高,便有Fe(OH)3和Cr(OH)3沉淀生成.图中A为电源正极(选填:“正”或“负”);
④阴极产生的气体为H2(写化学式).
⑤常温时Ksp[Cr(OH)3]=6.0×10-31,当废水的pH=7.0时,溶液中c(Cr3+)=6.0×10-10mol•L-1.
(1)常见镀铬液由重铬酸(H2Cr2O7)和催化剂硫酸组成.
①镀铬液在水溶液中存在如下平衡:Cr2O72-+H2O?2CrO42-+2H+该反应平衡常数表达式为K=$\frac{{c}^{2}(Cr{O}_{4}^{2-})•{c}^{2}({H}^{+})}{c(C{r}_{2}{O}_{7}^{2-})}$.
②镀铬时由CrO42-放电产生铬镀层.阴极的电极反应式为CrO42-+8H++6e-=Cr+4H2O.
③ABS塑料表面经处理后也可在其表面镀铬,ABS塑料的结构简式如下:
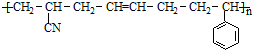 ,合成该聚合物的三种单体为:CH2=CHCN、CH2=CH-CH=CH2和
,合成该聚合物的三种单体为:CH2=CHCN、CH2=CH-CH=CH2和 (写结构简式).
(写结构简式).(2)工业上处理含铬废水有钡盐法、电解还原法等.
Ⅰ.钡盐法处理含铬废水主要流程为:

已知:
| 物质 | BaCO3 | CaSO4 | BaSO4 |
| Ksp | 8.1×10-9 | 9×10-6 | 1.1×10-10 |
②步骤二的目的是除去废水中Ba2+.
Ⅱ.电解法处理含六价铬(Cr2O72-和CrO42-)的强酸性废水,其原理如图所示.

③电解一段时间后随着溶液pH的升高,便有Fe(OH)3和Cr(OH)3沉淀生成.图中A为电源正极(选填:“正”或“负”);
④阴极产生的气体为H2(写化学式).
⑤常温时Ksp[Cr(OH)3]=6.0×10-31,当废水的pH=7.0时,溶液中c(Cr3+)=6.0×10-10mol•L-1.
5.下列对有机物结构或性质的描述,错误的是( )
| A. | 一定条件下,Cl2 可在甲苯的苯环或侧链上发生取代反应? | |
| B. | 苯酚钠溶液中通入CO2 生成苯酚,则碳酸的酸性比苯酚弱? | |
| C. | 乙烷和丙烯混合气体的物质的量共1 mol,完全燃烧生成3 mol H2O | |
| D. | 光照下,2,2-二甲基丙烷与Br2 反应其一溴取代物只有一种 |
12.取代反应是有机化学中的一类重要的反应,下列过程中发生取代反应的是( )
| A. | 乙烯通入溴的四氯化碳溶液发生反应 | |
| B. | 苯与浓硝酸、浓硫酸混和后加热至50℃~60℃发生反应 | |
| C. | 在苯中滴入溴水,振荡后溴水层褪色 | |
| D. | 乙烯通入酸性高锰酸钾溶液后溶液褪色 |
2. X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )
X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )
 X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )
X,Y,Z三种短周期元素在周期表中的位置如图,X通过共用三对电子形成X2分子.下列说法正确的是( )| A. | 化合物XZ3中各原子均满足8电子的稳定结构 | |
| B. | X,Y,Z三种元素形成的含氧酸都是强酸 | |
| C. | 常温下,Z单质可与Y的氢化物发生置换反应 | |
| D. | X3-与Al3+有相同的电子数,前者只有氧化性,后者只有还原性 |
9.下列离子方程式中,正确的是( )
| A. | 稀硫酸与氢氧化钡溶液反应:Ba2-+SO42-═BaSO4↓ | |
| B. | 氧化铜与稀硫酸混合:CuO+2H+═Cu2++H2O | |
| C. | 硫酸铜溶液与氢氧化钠溶液混合:CuSO4+OH-═Cu(OH)2↓+SO42- | |
| D. | 氯化铝溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
7.最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”-全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划.有关全氟丙烷的说法正确的是( )
| A. | 全氟丙烷不能使溴水褪色 | |
| B. | 全氟丙烷的电子式为: | |
| C. | 相同压强下,沸点:C3F8<C3H8 | |
| D. | 分子中三个碳原子可能处于同一直线上 |
 一种原电池的组成如图所示.试回答下列问题(灯泡功率合适):
一种原电池的组成如图所示.试回答下列问题(灯泡功率合适):