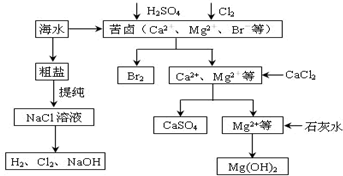
题目内容
8.下列有关试剂的保存方法不正确的是( )| A. | 把少量液溴、白磷放在水下 | |
| B. | 把铝片、镁条放置在不密封的纸盒里 | |
| C. | 把汽油、溴水放在带橡皮塞的玻璃试剂瓶中 | |
| D. | 把硝酸、硝酸银放在配有磨口玻璃塞的棕色瓶中 |
分析 A.液溴易挥发、白磷在空气中易燃,都应隔绝空气保存;
B.铝片、镁条有氧化膜;
C.汽油、溴水腐蚀橡皮塞;
D.硝酸、硝酸银不稳定,见光易分解.
解答 解:A.液溴易挥发、白磷在空气中易燃,都可以用水封,隔绝空气保存,故A正确;
B.铝片、镁条有氧化膜,可以放置在不密封的纸盒里,故B正确;
C.汽油、溴水腐蚀橡皮塞,故C错误;
D.硝酸、硝酸银不稳定,见光易分解,所以应保存在棕色瓶中,故D正确;
故选C.
点评 本题考查了药品的保存方法,题目难度不大,熟悉药品的性质是解题关键,注意相关知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.足量的铝分别与等体积等物质的量浓度的盐酸和氢氧化钠溶液反应,产生气体的体积是(相同条件)( )
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 1:3 |
19.25℃时,下列各溶液中有关物质的量浓度关系正确的是( )
| A. | 0.1mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| B. | pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液:c(CH3COONa)>c(Na2CO3)>c(C6H5ONa )>c(NaOH ) | |
| C. | NH4HSO4溶液中滴加NaOH溶液至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | 在饱和氯水中加入NaOH使pH=7,所得溶液中存在下列关系:c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |
16.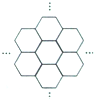 据报道,科学家己经研制出世界上最薄的材料一-碳膜片,其厚度只有一根头发的二十万分之一.如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是( )
据报道,科学家己经研制出世界上最薄的材料一-碳膜片,其厚度只有一根头发的二十万分之一.如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是( )
 据报道,科学家己经研制出世界上最薄的材料一-碳膜片,其厚度只有一根头发的二十万分之一.如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是( )
据报道,科学家己经研制出世界上最薄的材料一-碳膜片,其厚度只有一根头发的二十万分之一.如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是( )| A. | 碳膜片属于碳元素的同素异形体 | |
| B. | 碳膜片与C60是同一种物质 | |
| C. | 碳膜片属于人工合成的有机高分子材料 | |
| D. | 碳膜片在氧气中完全燃烧的产物和碳在氧气中完全燃烧的产物不同 |
20.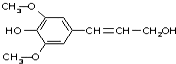 膳食纤维具有突出的保键功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )
膳食纤维具有突出的保键功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )
 膳食纤维具有突出的保键功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )
膳食纤维具有突出的保键功能,是人体的“第七营养素”.木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )| A. | 芥子醇能发生的反应类型有氧化、取代、水解、加聚 | |
| B. | 芥子醇的分子式是C11H14O4,属于芳香烃 | |
| C. | 芥子醇分子中所有碳原子可能在同一平面 | |
| D. | 芥子醇能与3mol溴水反应 |
18.下列关于热化学反应的描述中正确的是( )
| A. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0 kJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | Ba(OH)2•8H2O与NH4Cl反应的焓变小于0,所以在常温下能自发进行 |
 .
.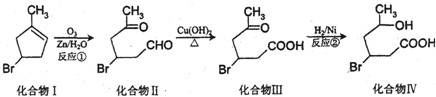
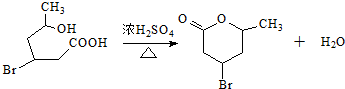 .
.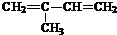 (2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物VI和VII,结构简式分别是为
(2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物VI和VII,结构简式分别是为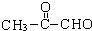 、HCHO.
、HCHO.