题目内容
4.假设A、B、C、D均为气体,反应A+3B=2C+D在四种不同情况下的反应速率分别为①vA=0.2mol/(L•s) ②vB=0.6mol/(L•s) ③vC=0.45mol/(L•s ) ④vD=0.3mol/(L•s) 该反应进行的最快的是④.(填序号)分析 不同物质表示的速率之比等于其化学计量数之比,故不同物质表示的速率与其化学计量数的比值越大,表示的反应速率越快.
解答 解:①$\frac{{v}_{A}}{1}$=0.2mol/(L•s);
②$\frac{{v}_{B}}{3}$=0.2mol/(L•s);
③$\frac{{v}_{C}}{2}$=0.225mol/(L•s);
④$\frac{{v}_{D}}{1}$=0.3mol/(L•s),
故反应速率:vD>vC>vA=vB.
故答案为:④.
点评 本题考查化学反应速率快慢比较,难度不大,利用比值法可以迅速判断,可以转化为同一物质表示的速率进行比较.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列说法正确的是( )
| A. | 18 g水中所含电子的物质的量为10 mol | |
| B. | N2和CO的摩尔质量相等,都是28 | |
| C. | 1 mol CO2的质量为44 g•mol-1 | |
| D. | 硫酸和磷酸的摩尔质量均为98 g |
12.下列说法正确的是( )
| A. | 按系统命名法,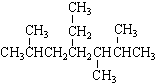 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次升高 | |
| C. | “糖类”物质均具有明显的甜味 | |
| D. | 1mol的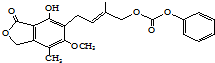 最多能与含5mol NaOH的水溶液完全反应 最多能与含5mol NaOH的水溶液完全反应 |
19.25℃时,下列各溶液中有关物质的量浓度关系正确的是( )
| A. | 0.1mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| B. | pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液:c(CH3COONa)>c(Na2CO3)>c(C6H5ONa )>c(NaOH ) | |
| C. | NH4HSO4溶液中滴加NaOH溶液至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| D. | 在饱和氯水中加入NaOH使pH=7,所得溶液中存在下列关系:c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |
16.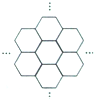 据报道,科学家己经研制出世界上最薄的材料一-碳膜片,其厚度只有一根头发的二十万分之一.如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是( )
据报道,科学家己经研制出世界上最薄的材料一-碳膜片,其厚度只有一根头发的二十万分之一.如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是( )
 据报道,科学家己经研制出世界上最薄的材料一-碳膜片,其厚度只有一根头发的二十万分之一.如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是( )
据报道,科学家己经研制出世界上最薄的材料一-碳膜片,其厚度只有一根头发的二十万分之一.如图所示,这种碳膜片状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是( )| A. | 碳膜片属于碳元素的同素异形体 | |
| B. | 碳膜片与C60是同一种物质 | |
| C. | 碳膜片属于人工合成的有机高分子材料 | |
| D. | 碳膜片在氧气中完全燃烧的产物和碳在氧气中完全燃烧的产物不同 |
14.某同学用某种粗盐进行提纯实验,步骤见下图.请回答:
(1)步骤②的操作名称是过滤.
(2)步骤③发生反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑.
步骤④加热蒸发时要用玻璃棒不断搅拌,目的是防止局部温度过高而溅出液体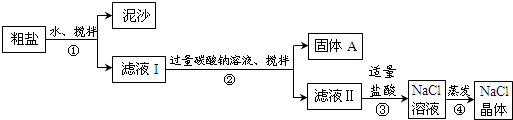
(3)猜想和验证:
(1)步骤②的操作名称是过滤.
(2)步骤③发生反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑.
步骤④加热蒸发时要用玻璃棒不断搅拌,目的是防止局部温度过高而溅出液体

(3)猜想和验证:
| 猜想 | 验证的方法 | 现象 | 结论 |
| 猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | ①有气泡冒出且澄清石灰水变浑浊 | 猜想Ⅰ成立 |
| 猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入②稀盐酸或稀硝酸,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | ③猜想II不成立 |
| 猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水, ④加入硝酸酸化的硝酸钡溶液 | ⑤产生不溶于稀硝酸的白色沉淀 | 猜想Ⅲ成立 |
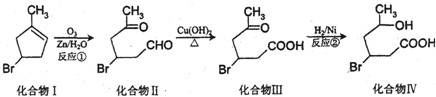
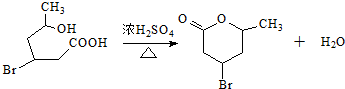 .
.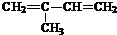 (2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物VI和VII,结构简式分别是为
(2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物VI和VII,结构简式分别是为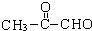 、HCHO.
、HCHO.