题目内容
18.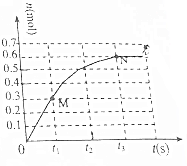 T℃时,向2L密闭恒容容器中充入1mol N2O4(无色气体)发生反应N2O4(g)?2NO2(g).其中NO2的物质的量随时间的变化如图所示.
T℃时,向2L密闭恒容容器中充入1mol N2O4(无色气体)发生反应N2O4(g)?2NO2(g).其中NO2的物质的量随时间的变化如图所示.(1)下列能说明反应N2O4(g)?2NO2(g)达到平衡状态的是ABD.
A.容器内气体的颜色不再改变
B.容器内气体的压强不再改变
C.容器内N2O4和NO2的物质的量之比为1:2
D.相同时间内,消耗1mol N2O4,同时消耗2mol NO2
(2)已知上述反应t3时达到平衡,则0~t3时间内NO2的平均反应速率为$\frac{0.6}{2{t}_{3}}$mol•L-1•s-1,平衡时N2O4的浓度为0.35mol•L-1,N2O4的转化率为30%.
(已知:转化率=已反应的原料的量/初始原料的总量×100%)
分析 (1)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论;
(2)0~t3时间内NO2的物质的量增大0.6mol,依据反应速率V=$\frac{△c}{△t}$,平衡浓度c=$\frac{n}{V}$,转化率=$\frac{消耗量}{起始量}$×100%计算.
解答 解:(1)A、NO2为红棕色气体,N2O4为无色气体,故体系颜色深浅不再发生改变时能说明反应达到平衡状态,故A正确;
B、反应前后气体的体积不等,故反应器中压强不再随时间变化时能说明反应达到平衡状态,故B正确;
C、平衡时各物质的分子数之比取决于物质的起始物质的量和转化率,故NO2的分子数与N2O4分子数比为2:1时不能说明反应达到平衡状态,故C错误;
D、相同时间内,消耗1mol N2O4,同时消耗2mol NO2说明正逆反应速率相同,证明反应达到平衡状态,故D正确;
故答案为:ABD;
(2)0~t3时间内NO2的物质的量增大0.6mol,v(NO2)=$\frac{\frac{0.6mol}{2L}}{{t}_{3s}}$=$\frac{0.6}{2{t}_{3}}$mol/(L•s),
依据化学平衡三段式列式计算
N2O4(g)?2NO2(g)
起始量(mol) 1 0
变化量(mol) 0.3 0.6
平衡量(mol) 0.7 0.6
平衡时N2O4的浓度=$\frac{0.7mol}{2L}$=0.35mol/L,
平衡时N2O4的转化率=$\frac{0.3mol}{1mol}$×100%=30%,
故答案为:$\frac{0.6}{2{t}_{3}}$;0.35;30%.
点评 本题考查了化学平衡标志和计算方法,图象分析判断,掌握基础是关键,题目较简单.

| A. | H2O和D2O | B. | O2和O3 | ||
| C. | CH3CH2OH和CH3-O-CH3 | D. | 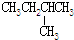 和 和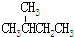 |
| A. | 该反应属于置换反应 | B. | 该反应的还原剂是NH3 | ||
| C. | Cl2的氧化性小于N2 | D. | 被氧化的NH3占参加反应NH3的1/4 |
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(1)写出下列元素的名称:C钠,E氯
(2)B、C、D的简单离子半径由大到小的顺序是(用化学式表示)O2->Mg2+>Al3+
(3)①写出E单质与A、B、C形成的化合物反应的化学方程式Cl2+2OH-=Cl-+ClO-+H2O
②D单质与A、B、C形成的化合物的水溶液反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(4)用电子式表示C2B的形成过程
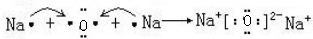 .
. | A. | 0.1 mol OH-含有6.02×1023个电子 | |
| B. | 氯化氢气体的摩尔质量等于6.02×1023氯气分子和6.02×1023个氢分子的质量之和 | |
| C. | 1 mol醋酸的质量与6.02×1023个醋酸分子的质量相等 | |
| D. | 28 g氮气所含的原子数目为12.04×1023 |
| A. | Na+Fe3+ Cl-NO3- (1:1:3:1) | |
| B. | Ca2+ K+ OH- HCO3- (1:1:2:1) | |
| C. | H+ SO42- OH- Ba2+ (2:1:2:1) | |
| D. | Na+ PO43- H+ SO42- (2:1:3:1) |
| A. | 金刚石>晶体硅>二氧化硅>碳化硅 | B. | CI4>CBr4>CCl4>CH4 | ||
| C. | MgO>Na2O>N2>O2 | D. | 金刚石>生铁>纯铁>钠 |
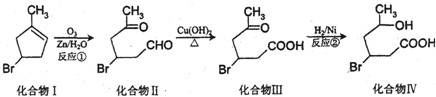
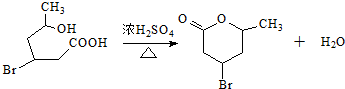 .
.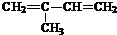 (2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物VI和VII,结构简式分别是为
(2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物VI和VII,结构简式分别是为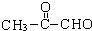 、HCHO.
、HCHO.