题目内容
19.下列现象与氢键有关的是( )①NH3的熔、沸点比PH3的高
②乙醇、乙酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素
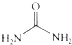 的熔、沸点比醋酸
的熔、沸点比醋酸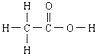 的高.
的高.⑤晶体熔点的高低:
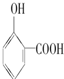
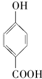 >
>
⑥水分子高温下很稳定.
| A. | ①②③④⑤⑥ | B. | ①②③④⑤ | C. | ①②③④ | D. | ①②③ |
分析 ①结构相似的分子,含有氢键的物质熔沸点较高;
②醇、羧酸与水分子之间能形成氢键;
③冰中存在氢键,其体积变大;
④尿素分子间可以形成多个氢键(2个N原子、1个O原子),醋酸分子间只有1个氢键(只有羟基可以形成氢键);
⑤对羟基苯甲酸易形成分子之间氢键;
⑥稳定性与化学键有关.
解答 解:①氨气和膦的结构相似,但氨气分子中存在氢键,膦中只含分子间作用力,氢键的存在导致物质的熔、沸点升高,故①选;
②乙醇、乙酸与水分子之间能形成氢键,则可以和水以任意比互溶,故②正确;
③冰中存在氢键,其体积变大,则相同质量时冰的密度比液态水的密度小,故③正确;
④尿素分子间可以形成的氢键比醋酸分子间形成的氢键多,尿素的熔、沸点比醋酸的高,故④正确;
⑤对羟基苯甲酸易形成分子之间氢键,而邻羟基苯甲酸形成分子内氢键,所以邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低,故⑤正确;
⑥水分子高温下也很稳定,其稳定性与化学键有关,而与氢键无关,故⑥错误;
故选B.
点评 本题考查氢键及氢键对物质的性质的影响,明确氢键主要影响物质的物理性质是解答本题的关键,题目难度不大.

练习册系列答案
相关题目
15.在50mL FeCl3和CuCl2的混合溶液中,FeCl3和CuCl2的浓度均为1mol/L,在混合溶液中加入100mL NaOH溶液,恰好完全反应,则该NaOH溶液的浓度为( )
| A. | 0.5mol/L | B. | 1mol/L | C. | 1.25mol/L | D. | 2.5mol/L |
7.下列各组离子在溶液中一定能大量共存的是( )
| A. | pH=0的溶液中:ClO-、Cu2+、SO42-、K+ | |
| B. | 使pH试纸变红色的溶液中:Fe2+、I-、NO3-、Cl- | |
| C. | 能够和金属镁反应放出气体的溶液中:Na+、H+、SO42-、Cl- | |
| D. | 常温下,水电离出的c(H+)与c(OH-)乘积为10-28的溶液中:K+、Na+、HS-、Ca2+ |
4.针对下面10种元素,完成以下各小题.
(1)常温下,会在浓硫酸中发生钝化的金属是铝(填名称).
(2)化学性质最不活泼的元素是Ne(填元素符号).
(3)镁的原子结构示意图为 .
.
(4)C与N相比,原子半径较小的是N.
(5)最高价氧化物对应的水化物酸性最强的是HClO4碱性最强的是NaOH(填化学式).
(6)常用于制半导体材料的元素是硅.
(7)H2S和HCl相比,热稳定性较强的是HCl.
(8)硫的一种氧化物可使品红溶液褪色,写出该氧化物的化学式SO2,其中硫元素和氧元素的质量比m(S):m(O)=1:1.
(9)常温下金属钠能与水激烈反应,请写出反应的化学方程式:2Na+2H2O=2NaOH+H2↑.
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
(2)化学性质最不活泼的元素是Ne(填元素符号).
(3)镁的原子结构示意图为
 .
.(4)C与N相比,原子半径较小的是N.
(5)最高价氧化物对应的水化物酸性最强的是HClO4碱性最强的是NaOH(填化学式).
(6)常用于制半导体材料的元素是硅.
(7)H2S和HCl相比,热稳定性较强的是HCl.
(8)硫的一种氧化物可使品红溶液褪色,写出该氧化物的化学式SO2,其中硫元素和氧元素的质量比m(S):m(O)=1:1.
(9)常温下金属钠能与水激烈反应,请写出反应的化学方程式:2Na+2H2O=2NaOH+H2↑.
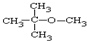 .
.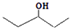 ,乙所含官能团的名称为羟基.
,乙所含官能团的名称为羟基.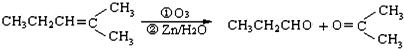
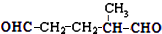 ,则烃A的结构可表示为
,则烃A的结构可表示为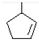 .
.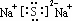 .
.
 .
.