题目内容
7.下列各组离子在溶液中一定能大量共存的是( )| A. | pH=0的溶液中:ClO-、Cu2+、SO42-、K+ | |
| B. | 使pH试纸变红色的溶液中:Fe2+、I-、NO3-、Cl- | |
| C. | 能够和金属镁反应放出气体的溶液中:Na+、H+、SO42-、Cl- | |
| D. | 常温下,水电离出的c(H+)与c(OH-)乘积为10-28的溶液中:K+、Na+、HS-、Ca2+ |
分析 A、PH=0说明溶液显酸性,次氯酸根离子是弱酸阴离子不能在酸溶液中共存;
B、使pH试纸变红色的溶液显酸性,Fe2+、I-、NO3-不能共存;
C、能够和金属镁反应放出气体的溶液显酸性;
D、常温下由水电离出的c(H+)与c(OH-)乘积为10-28的溶液,则水电离的氢离子为10-14mol/L,该溶液为酸性或碱性溶液,HS-离子既能够与酸溶液反应,也能够与碱溶液反应.
解答 解:A、PH=0说明溶液显酸性,次氯酸根离子是弱酸阴离子,结合氢离子形成弱酸HClO、不能在酸溶液中共存,故A错误;
B、使pH试纸变红色的溶液显酸性,Fe2+、I-离子具有还原性在酸溶液中被NO3-氧化不能共存,故B错误;
C、能够和金属镁反应放出气体的溶液显酸性,酸溶液中Na+、H+、SO42-、Cl- 可以大量共存,故C正确;
D、常温下由水电离出的c(H+)与c(OH-)乘积为10-28的溶液,则水电离的氢离子为10-14mol/L,该溶液中存在大量氢离子或氢氧根离子,HS-离子既能够与酸溶液反应,也能够与碱溶液反应,在溶液中一定不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的正误判断,为中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
3.已知下列键能数据,则反应:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g)△H为( )
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
| A. | 236 kJ•mol-1 | B. | -116 kJ•mol-1 | C. | -236 kJ•mol-1 | D. | 116 kJ•mol-1 |
4.一定条件下,可逆反应X(g)+3Y(g)?2Z(g),若X、Y、Z的起始浓度分别为C1、C2、C3(均不为0),平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L/、0.08mol/L,下列判断不合理的是( )
| A. | C1:C2=1:3 | B. | 平衡时,X和Z的生成速率之比为1:2 | ||
| C. | X、Y的转化率不相等 | D. | C1的取值范围为0<C1<0.14mol/L |
2.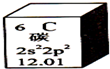 元素周期表是学习化学的重要工具.下图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
元素周期表是学习化学的重要工具.下图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
 元素周期表是学习化学的重要工具.下图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
元素周期表是学习化学的重要工具.下图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )| A. | 该元素的三种核素质子数均为6 | B. | 该元素原子最外层有4个电子 | ||
| C. | 该元素的相对原子质量为12.01 | D. | 该元素的原子核外有三个电子层 |
19.下列现象与氢键有关的是( )
①NH3的熔、沸点比PH3的高
②乙醇、乙酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素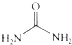 的熔、沸点比醋酸
的熔、沸点比醋酸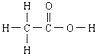 的高.
的高.
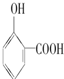
⑤晶体熔点的高低: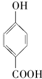 >
>
⑥水分子高温下很稳定.
①NH3的熔、沸点比PH3的高
②乙醇、乙酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素
 的熔、沸点比醋酸
的熔、沸点比醋酸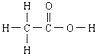 的高.
的高.⑤晶体熔点的高低:
 >
>
⑥水分子高温下很稳定.
| A. | ①②③④⑤⑥ | B. | ①②③④⑤ | C. | ①②③④ | D. | ①②③ |
16.在其他条件不变时,只改变某一条件,化学反应aA(g)+B(g)?cC(g)的平衡的变化图象如图(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率),据此分析下列说法正确的是( )
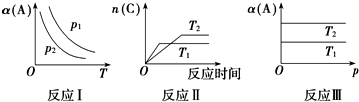

| A. | 在图象反应Ⅰ中,说明正反应为吸热反应 | |
| B. | 在图象反应Ⅰ中,若p1>p2,则此反应的△S>0 | |
| C. | 在图象反应Ⅱ中,说明该正反应为吸热反应 | |
| D. | 在图象反应Ⅲ中,若T1>T2,则该反应能自发进行 |
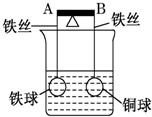 如图杠杆AB两端分别挂着体积相同质量相同的空心铁球和空心铜球.调节杠杆使其保持平衡,一段时间后小心加入浓CuSO4溶液,回答下列有关问题(不考虑铁丝反应和两球的浮力变化)
如图杠杆AB两端分别挂着体积相同质量相同的空心铁球和空心铜球.调节杠杆使其保持平衡,一段时间后小心加入浓CuSO4溶液,回答下列有关问题(不考虑铁丝反应和两球的浮力变化)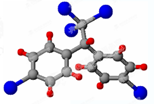 按要求完成下列问题:
按要求完成下列问题: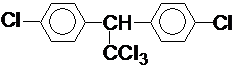 ;
;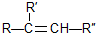 在一定条件下氧化可得产物
在一定条件下氧化可得产物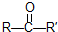 和
和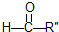 .某烃1mol在一定条件下氧化得到产物
.某烃1mol在一定条件下氧化得到产物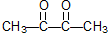 和OHCCH2CH2CHO各1mol.这种烃的结构简式是
和OHCCH2CH2CHO各1mol.这种烃的结构简式是 .
.