题目内容
8.亚硝酸钠(化学式为NaNO2)是一种外观极像食盐,且有与食盐一样的咸味的物质,少量的亚硝酸钠具有防腐和着色作用,既有氧化性又有还原性.在酸性溶液中能氧化碘离子、亚铁离子.它能将人体血红蛋白里所含的亚铁离子氧化成三价铁离子而使人中毒.这种工业用盐常被冒充食盐掺假或被误作食盐使用,导致多起中毒事故发生.亚硝酸钠与酸反应生成不稳定的弱酸,它只能存在于冷的稀溶液中,易发生如下的分解反应:3HNO2═2NO↑+HNO3+H2O 又知NO在空气中易被氧气氧化成红棕色的NO2.从浓醋酸、氨水、纯碱、稀盐酸、碘化钾淀粉溶液中选择适当的试剂,用两种简单的化学实验鉴别亚硝酸钠和氯化钠.试写出两种实验方法使用的试剂和据以鉴别它们的现象:
方法一:(只用一种试剂)试剂:稀盐酸,现象:出现红棕色气体;
方法二:试剂:碘化钾淀粉溶液和酸,现象:溶液变蓝色.
分析 方法一:亚硝酸钠与酸反应生成不稳定的弱酸,易发生分解反应:3HNO2═2NO↑+HNO3+H2O,生成的NO在空气中易被氧气氧化成红棕色的NO2;氯化钠和稀盐酸不反应,根据与酸反应是否生成红棕色气体检验两种钠盐;
方法二:亚硝酸钠具有氧化性,酸性条件下能氧化碘离子生成碘,碘遇淀粉试液变蓝色.
解答 解:方法一:亚硝酸钠与酸反应生成不稳定的弱酸,易发生分解反应:3HNO2═2NO↑+HNO3+H2O,生成的NO在空气中易被氧气氧化成红棕色的NO2;氯化钠和醋酸、稀盐酸不反应,根据与酸反应是否生成红棕色气体检验两种钠盐,所以可以选取的试剂是稀盐酸,看到的现象是出现红棕色气体;
方法二:亚硝酸钠具有氧化性,酸性条件下能氧化碘离子生成碘,碘遇淀粉试液变蓝色,所以选取的试剂是酸和碘化钾淀粉溶液,看到的现象是溶液变蓝色,
故答案为:稀盐酸;出现红棕色气体;碘化钾淀粉溶液和酸;溶液变蓝色.
点评 本题考查物质检验和鉴别实验方案设计,侧重考查获取信息利用信息解答问题能力,根据题给信息来选取合适的试剂是解本题关键,知道常见元素化合物性质,题目难度不大.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案
相关题目
4.一定条件下,可逆反应X(g)+3Y(g)?2Z(g),若X、Y、Z的起始浓度分别为C1、C2、C3(均不为0),平衡时,X、Y、Z的浓度分别为0.1mol/L、0.3mol/L/、0.08mol/L,下列判断不合理的是( )
| A. | C1:C2=1:3 | B. | 平衡时,X和Z的生成速率之比为1:2 | ||
| C. | X、Y的转化率不相等 | D. | C1的取值范围为0<C1<0.14mol/L |
19.下列现象与氢键有关的是( )
①NH3的熔、沸点比PH3的高
②乙醇、乙酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素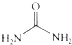 的熔、沸点比醋酸
的熔、沸点比醋酸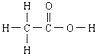 的高.
的高.
⑤晶体熔点的高低: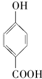 >
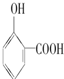
>
⑥水分子高温下很稳定.
①NH3的熔、沸点比PH3的高
②乙醇、乙酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素
 的熔、沸点比醋酸
的熔、沸点比醋酸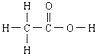 的高.
的高.⑤晶体熔点的高低:
 >
>
⑥水分子高温下很稳定.
| A. | ①②③④⑤⑥ | B. | ①②③④⑤ | C. | ①②③④ | D. | ①②③ |
16.在其他条件不变时,只改变某一条件,化学反应aA(g)+B(g)?cC(g)的平衡的变化图象如图(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率),据此分析下列说法正确的是( )
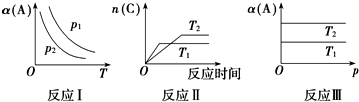

| A. | 在图象反应Ⅰ中,说明正反应为吸热反应 | |
| B. | 在图象反应Ⅰ中,若p1>p2,则此反应的△S>0 | |
| C. | 在图象反应Ⅱ中,说明该正反应为吸热反应 | |
| D. | 在图象反应Ⅲ中,若T1>T2,则该反应能自发进行 |
3. 已知下表所示数据:
已知下表所示数据:
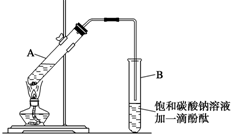
某学生实验室制取乙酸乙酯的主要步骤如下:
①在30mL的大试管A中按体积比2:3:3配制浓硫酸、乙醇和乙酸的混合溶液.
②按如图连接好装置(装置气密性良好),用小火均匀加热装有混合液的大试管 5~10 min.
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层.
④分离出乙酸乙酯层,洗涤、干燥.
请根据题目要求回答下列问题:
(1)配制该混合液的主要操作步骤为在一个30 mL的大试管中注入3 mL乙醇,再分别缓缓加入2 mL浓硫酸、3mL 乙酸(乙醇和浓硫酸的加入顺序不可互换),边加边振荡试管使之混合均匀.
(2)导管不能插入到Na2CO3溶液中的原因是防止倒吸回流现象的发生.
(3)步骤②中需要小火均匀加热,其主要原因是反应物乙醇、乙酸的沸点较低,若用大火加热,反应物随产物蒸出而大量损失,而且温度过高可能发生更多的副反应.
(4)指出步骤③所观察到的现象:试管B中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅;
(5)充分振荡试管,然后静置,待液体分层后,分液得到的上层液体即为乙酸乙酯.分离出乙酸乙酯层后,可以用用B洗涤.
A.乙醇 B.饱和食盐水
C.碳酸钠溶液 D.NaOH溶液.
 已知下表所示数据:
已知下表所示数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.3 | 78.5 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | 338.0 | 1.84 |
①在30mL的大试管A中按体积比2:3:3配制浓硫酸、乙醇和乙酸的混合溶液.
②按如图连接好装置(装置气密性良好),用小火均匀加热装有混合液的大试管 5~10 min.
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层.
④分离出乙酸乙酯层,洗涤、干燥.
请根据题目要求回答下列问题:
(1)配制该混合液的主要操作步骤为在一个30 mL的大试管中注入3 mL乙醇,再分别缓缓加入2 mL浓硫酸、3mL 乙酸(乙醇和浓硫酸的加入顺序不可互换),边加边振荡试管使之混合均匀.
(2)导管不能插入到Na2CO3溶液中的原因是防止倒吸回流现象的发生.
(3)步骤②中需要小火均匀加热,其主要原因是反应物乙醇、乙酸的沸点较低,若用大火加热,反应物随产物蒸出而大量损失,而且温度过高可能发生更多的副反应.
(4)指出步骤③所观察到的现象:试管B中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅;
(5)充分振荡试管,然后静置,待液体分层后,分液得到的上层液体即为乙酸乙酯.分离出乙酸乙酯层后,可以用用B洗涤.
A.乙醇 B.饱和食盐水
C.碳酸钠溶液 D.NaOH溶液.
20.把amolH2和bmolC2H4混合,在一定条件下使他们一部分发生反应生成wmol C2H6,将反应后所得的混合气体完全燃烧,消耗O2的物质的量为( )
| A. | a+3b | B. | $\frac{a}{2}$+3b | C. | $\frac{a}{2}$+3b+$\frac{7w}{2}$ | D. | $\frac{a}{2}$+3b-$\frac{7w}{2}$ |
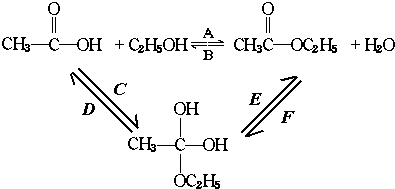
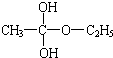 再转化为酯和水,以上反应均为可逆反应,回答下列问题:
再转化为酯和水,以上反应均为可逆反应,回答下列问题: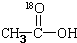 进行该实验,18O可存在于哪些物质中A、C
进行该实验,18O可存在于哪些物质中A、C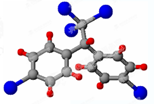 按要求完成下列问题:
按要求完成下列问题: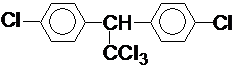 ;
;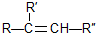 在一定条件下氧化可得产物
在一定条件下氧化可得产物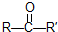 和
和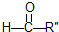 .某烃1mol在一定条件下氧化得到产物
.某烃1mol在一定条件下氧化得到产物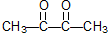 和OHCCH2CH2CHO各1mol.这种烃的结构简式是
和OHCCH2CH2CHO各1mol.这种烃的结构简式是 .
.