题目内容
14.有机物甲可作为无铅汽油的抗爆震剂,其相对分子质量为Mr(甲),80<Mr(甲)<100.取1mol甲在足量氧气中完全燃烧后,生成5molCO2和6molH2O.(1)Mr(甲)=88,甲的分子式为C5H12O;
(2)甲的核磁共振氢谱有两个峰,峰面积之比为3:1,则甲的结构简式为
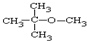 .
.(3)烯烃丙与水加成可生成乙,乙为甲的同分异构体,红外光谱显示乙中有-OH和对称的-CH2-、-CH3等,
①丙的名称2-戊烯.
②乙的键线式为
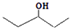 ,乙所含官能团的名称为羟基.
,乙所含官能团的名称为羟基.③乙同类别的同分异构体中,含有3个-CH3的结构有3种.
(4)已知烯烃通过臭氧氧化并经锌和水处理得到醛或酮.例如:
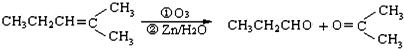
上述反应可用来推断烃分子中碳碳双键的位置.
某烃A的分子式为C6H10,经过上述转化生成
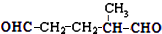 ,则烃A的结构可表示为
,则烃A的结构可表示为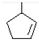 .
.
分析 (1)1mol甲在足量氧气中完全燃烧后,生成5molCO2和6molH2O,根据原子守恒知,甲中含有5个C原子、12个H原子,因为80<Mr(甲)<100,则$\frac{80-12×5-1×12}{16}$<O原子个数<$\frac{100-12×5-1×12}{16}$,则O原子个数为1,则甲分子式为C5H12O;
(2)甲的核磁共振氢谱有两个峰,峰面积之比为3:1,说明含有两种氢原子,且氢原子个数之比为3:1;
(3)烯烃丙与水加成可生成乙,则乙为醇,乙为甲的同分异构体,红外光谱显示乙中有-OH和对称的-CH2-、-CH3等,则乙为CH3CH2CH(OH)CH2CH3,丙为CH3CH=CHCH2CH3;
(4)某烃A的分子式为C6H10,A中不饱和度=$\frac{6×2+2-10}{2}$=2,则A含有两个碳碳双键或一个碳碳三键或存在环状结构且含有一个碳碳双键,A通过臭氧氧化并经锌和水处理得到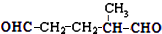 ,说明A中含有一个环且含有一个碳碳双键.
,说明A中含有一个环且含有一个碳碳双键.
解答 解:(1)1mol甲在足量氧气中完全燃烧后,生成5molCO2和6molH2O,根据原子守恒知,甲中含有5个C原子、12个H原子,因为80<Mr(甲)<100,则$\frac{80-12×5-1×12}{16}$<O原子个数<$\frac{100-12×5-1×12}{16}$,则O原子个数为1,则甲分子式为C5H12O,甲相对分子质量=12×5+1×12+16×1=88;
故答案为:88;C5H12O;
(2)甲的核磁共振氢谱有两个峰,峰面积之比为3:1,说明含有两种氢原子,且氢原子个数之比为3:1结合甲的分子式知,其结构简式为 ,故答案为:
,故答案为: ;
;
(3)烯烃丙与水加成可生成乙,则乙为醇,乙为甲的同分异构体,红外光谱显示乙中有-OH和对称的-CH2-、-CH3等,则乙为CH3CH2CH(OH)CH2CH3,丙为CH3CH=CHCH2CH3;
①丙的名称是2-戊烯,故答案为:2-戊烯;
②乙的键线式为 ,官能团名称是羟基,故答案为:
,官能团名称是羟基,故答案为: ;羟基;
;羟基;
③乙为CH3CH2CH(OH)CH2CH3,乙同类别的同分异构体中,含有3个-CH3的结构,其结构简式为(CH3)2CH(OH)CH2CH3、(CH3)2CHCH(0H)CH3、(CH3)3CH2CH2OH,所以有3种,
故答案为:3;
(4)某烃A的分子式为C6H10,A中不饱和度=$\frac{6×2+2-10}{2}$=2,则A含有两个碳碳双键或一个碳碳三键或存在环状结构且含有一个碳碳双键,A通过臭氧氧化并经锌和水处理得到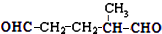 ,说明A中含有一个环且含有一个碳碳双键,将两个醛基转化为碳碳双键即是A结构简式,则A结构简式为
,说明A中含有一个环且含有一个碳碳双键,将两个醛基转化为碳碳双键即是A结构简式,则A结构简式为 ,故答案为:
,故答案为: .
.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断、知识迁移能力及发散思维能力,会根据题给信息分析解答是解本题关键,注意:环的不饱和度是1,易错点是同分异构体种类判断,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由单质A转化为单质B△H=+119kJ•mol-1,可知单质B比单质A稳定 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1 | |
| D. | 在25°C、101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ量,则表示H2燃烧热的化学方程式 2H2(g)+O2(g)═2H2O(l)△H=-571kJ•mol-1 |
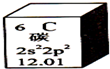 元素周期表是学习化学的重要工具.下图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
元素周期表是学习化学的重要工具.下图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )| A. | 该元素的三种核素质子数均为6 | B. | 该元素原子最外层有4个电子 | ||
| C. | 该元素的相对原子质量为12.01 | D. | 该元素的原子核外有三个电子层 |
| A. | 甘油、氨基酸在一定条件下都能发生酯化反应 | |
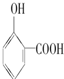
| B. | 菲的结构简式为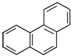 ,它的一硝基取代物共有10种 ,它的一硝基取代物共有10种 | |
| C. | 某有机物分子式为C14H12O2,球棍模型如图所示,此有机物能与NaHCO3溶液反应放出CO2气体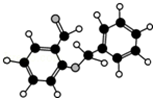 | |
| D. | 分别完全燃烧等物质的量的果糖和蔗糖,消耗的氧气量相等 |
①NH3的熔、沸点比PH3的高
②乙醇、乙酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素
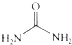 的熔、沸点比醋酸
的熔、沸点比醋酸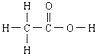 的高.
的高.⑤晶体熔点的高低:
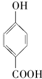 >
>
⑥水分子高温下很稳定.
| A. | ①②③④⑤⑥ | B. | ①②③④⑤ | C. | ①②③④ | D. | ①②③ |
| A. | 要鉴别己烯中是否混有少量甲苯,应先加足量溴水,然后再加入酸性高锰酸钾溶液 | |
| B. | 配制浓硫酸和浓硝酸的混酸时,将浓硝酸沿壁缓缓倒入到浓硫酸中 | |
| C. | 制硝基苯时,将盛有混合液的试管直接在酒精灯火焰上加热 | |
| D. | 除去溴苯中少量的溴,可以加水后分液 |
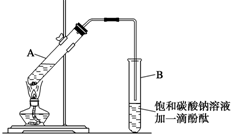 已知下表所示数据:
已知下表所示数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.3 | 78.5 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | 338.0 | 1.84 |
①在30mL的大试管A中按体积比2:3:3配制浓硫酸、乙醇和乙酸的混合溶液.
②按如图连接好装置(装置气密性良好),用小火均匀加热装有混合液的大试管 5~10 min.
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层.
④分离出乙酸乙酯层,洗涤、干燥.
请根据题目要求回答下列问题:
(1)配制该混合液的主要操作步骤为在一个30 mL的大试管中注入3 mL乙醇,再分别缓缓加入2 mL浓硫酸、3mL 乙酸(乙醇和浓硫酸的加入顺序不可互换),边加边振荡试管使之混合均匀.
(2)导管不能插入到Na2CO3溶液中的原因是防止倒吸回流现象的发生.
(3)步骤②中需要小火均匀加热,其主要原因是反应物乙醇、乙酸的沸点较低,若用大火加热,反应物随产物蒸出而大量损失,而且温度过高可能发生更多的副反应.
(4)指出步骤③所观察到的现象:试管B中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅;
(5)充分振荡试管,然后静置,待液体分层后,分液得到的上层液体即为乙酸乙酯.分离出乙酸乙酯层后,可以用用B洗涤.
A.乙醇 B.饱和食盐水
C.碳酸钠溶液 D.NaOH溶液.
| A. | Zn与盐酸反应 | B. | CaO与H2O反应 | C. | NaOH与盐酸反应 | D. | C和H2O(g)反应 |

