题目内容
4.某有机物的结构简式为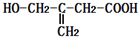 ,该有机物不可能发生的化学反应是( )
,该有机物不可能发生的化学反应是( )| A. | 还原 | B. | 水解 | C. | 氧化 | D. | 取代 |
分析 该分子中含有醇羟基、碳碳双键和羧基,具有醇、烯烃和羧酸的性质,能发生氧化反应、加成反应、还原反应、取代反应、酯化反应、中和反应、缩聚反应等,据此分析解答.
解答 解:该分子中含有醇羟基、碳碳双键和羧基,具有醇、烯烃和羧酸的性质,含有碳碳双键,所以能发生还原反应;含有碳碳双键和醇羟基,所以能发生氧化反应,含有醇羟基和羧基,所以能发生取代反应,没有卤原子或酯基、肽键,所以不能发生水解反应,故选B.
点评 本题考查有机物结构和性质,明确官能团及其性质关系是解本题关键,侧重考查烯烃、醇和羧酸的性质,熟悉常见有机物反应类型及反应条件,题目难度不大.

练习册系列答案
相关题目
8.下列原子序数对应的元素间易形成共价键的是( )
| A. | 11和17 | B. | 19和9 | C. | 13和17 | D. | 20和8 |
15.如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )


| A. | 离子半径:M->Z2->Y- | |
| B. | Z元素形成的氧化物都是共价化合物 | |
| C. | 气态氢化物稳定性:Y>Z>M | |
| D. | 三种元素中,M的最高价氧化物对应的水化物酸性最强 |
12.下列有关实验现象和解释或结论都正确的是( )
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 把SO2通入紫色石蕊试液中 | 紫色褪去 | SO2具有漂白性 |
| B | 把浓硫酸滴到pH试纸上 | 试纸变红 | 浓硫酸具有酸性 |
| C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2?N2O4 的△H>0 |
| D | 铝箔在酒精灯火焰上加热 | 铝箔熔化但不滴落 | 铝箔表面氧化铝熔点高于铝 |
| A. | A | B. | B | C. | C | D. | D |
19.如图是一套电化学装置,a、b、c、d都是石墨电极,对其有关说法错误的是( )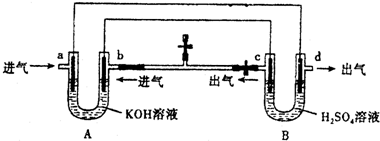

| A. | 装置A是原电池,装置B是电解池 | |
| B. | 反应一段时间后,装置B中溶液PH增大 | |
| C. | a口若消耗1molCH4,d口可产生4mol气体 | |
| D. | a口通入C2H6时的电极反应为 C2H6-14e-+18OH-═2CO32-+12H2O |
16.下列指定反应的离子方程式正确的是( )
| A. | 向FeCl3溶液中滴加HI溶液:Fe3++2I-═Fe2++I2 | |
| B. | 向AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2−+4NH4++2H2O | |
| C. | 向稀NH4HCO3溶液中加入过量NaOH溶液:NH4++OH-═NH3•H2O | |
| D. | 向苯酚钠溶液中通入少量CO2: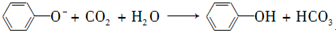 - - |
13.一种抗高血压的药物甲基多巴的结构简式如图所示,下列说法正确的是( )
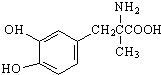

| A. | 1 mol甲基多巴的分子中含有4 mol双键 | |
| B. | 每个甲基多巴分子中含有一个手性碳原子 | |
| C. | 1 mol甲基多巴最多能与2 mol Br2发生取代反应 | |
| D. | 甲基多巴既能与盐酸反应,又能与氢氧化钠溶液反应 |
14.已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加.相关信息如下表所示,根据推断回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)E在周期表中位于第四周期第ⅠB族
(2)A、B、D三种元素电负性由大到小排列顺序为N>C>Si
(3)A和B的最简单氢化物中沸点较高的NH3.原因是NH3分子间存在氢键.
(4)已知:
①AH4(g)+2BO2(g)-B2(g)+AO2(g)+2H2O(g) H1=-867kJ•mol-1
②2BO2(g)-B2 O4(g) H2=-56.9kJ•mol-1
写出AH4和B2O4反应的热化学方程式CH4(g)+N2O4(g)═N2(g)+CO2(g)+2H2O(g)△H=-810.1kJ/mol.
| A | A的一种单质在自然界中硬度最大 |
| B | B元素的第一电离能比同周期相邻两个元素都大 |
| C | 同周期中,C元素的最高价氧化物对应的水化物的碱性最强 |
| D | D的基态原子M层电子数是K层的2 倍 |
| E | E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满 |
(2)A、B、D三种元素电负性由大到小排列顺序为N>C>Si
(3)A和B的最简单氢化物中沸点较高的NH3.原因是NH3分子间存在氢键.
(4)已知:
①AH4(g)+2BO2(g)-B2(g)+AO2(g)+2H2O(g) H1=-867kJ•mol-1
②2BO2(g)-B2 O4(g) H2=-56.9kJ•mol-1
写出AH4和B2O4反应的热化学方程式CH4(g)+N2O4(g)═N2(g)+CO2(g)+2H2O(g)△H=-810.1kJ/mol.