题目内容
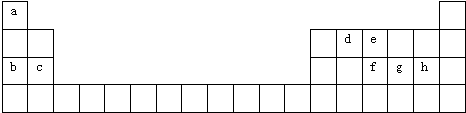
15.如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( )
| A. | 离子半径:M->Z2->Y- | |
| B. | Z元素形成的氧化物都是共价化合物 | |
| C. | 气态氢化物稳定性:Y>Z>M | |
| D. | 三种元素中,M的最高价氧化物对应的水化物酸性最强 |
分析 由短周期元素在周期表中的位置可知,X为He、Y为F、M为Cl、Z为S,
A.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大;
B.非金属性氧化物属于共价化合物;
C.非金属性越强,氢化物越稳定;
D.高氯酸是酸性最强的含氧酸.
解答 解:由短周期元素在周期表中的位置可知,X为He、Y为F、M为Cl、Z为S,
A.电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->Cl->F-,故A错误;
B.二氧化硫、三氧化硫都是非金属性氧化物,属于共价化合物,故B正确;
C.非金属性Y>M>Z,故氢化物越稳定Y>M>Z,故C错误;
D.高氯酸是酸性最强含氧酸,F没有最高价含氧酸,所以三种元素中,M的最高价氧化物对应的水化物酸性最强,故D正确,
故选BD.
点评 本题考查元素周期表与元素周期律,难度不大,注意掌握元素周期律及微粒半径比较规律.

练习册系列答案
相关题目
19.某有机物的氧化产物甲和还原产物乙都能与金属钠反应放出H2,甲、乙反应可生成丙,甲、丙都能发生银镜反应,此有机物是( )
| A. | 甲醛 | B. | 乙醛 | C. | 甲酸 | D. | 乙酸 |
20.一定温度下,在固定容积的密闭容器中发生下列反应:2HI(g)?H2(g)+I2(g).若HI浓度由0.1mol•L-1降到0.07mol•L-1时,需要15s,那么HI浓度由0.07mol•L-1降到0.05mol•L-1时,所需反应的时间为( )
| A. | 等于5 s | B. | 大于10 s | C. | 等于10 s | D. | 小于10 s |
3.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2•6H2O的工艺流程如图1:
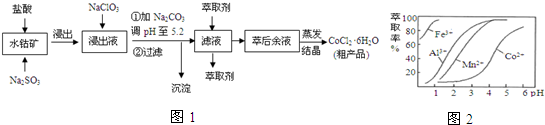
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出浸出液加入NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O
(3)加Na2CO3调pH至5.2所得沉淀为Fe(OH)3、Al(OH)3.
(4)萃取剂对金属离子的萃取率与pH的关系如图2.萃取剂的作用是除去溶液中的Mn2+;其使用的较适宜pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质 量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)写出浸出液加入NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O
(3)加Na2CO3调pH至5.2所得沉淀为Fe(OH)3、Al(OH)3.
(4)萃取剂对金属离子的萃取率与pH的关系如图2.萃取剂的作用是除去溶液中的Mn2+;其使用的较适宜pH范围是B.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)为测定粗产品中CoCl2•6H2O含量,称取一定质 量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
10.下列说法错误的是( )
| A. | 乙醇和二甲醚互为同分异构体,利用红外光谱法或核磁共振氢谱法均可鉴别两者 | |
| B. | 醋酸和硬脂酸互为同系物,C2H4和C18H38也互为同系物 | |
| C. | 有机物W(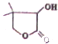 )和其水解产物都可以发生消去反应 )和其水解产物都可以发生消去反应 | |
| D. | 乙烯的加成反应及与酸性KMnO4溶液作用,都与其分子内碳碳双健有关 |
4.某有机物的结构简式为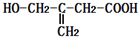 ,该有机物不可能发生的化学反应是( )
,该有机物不可能发生的化学反应是( )
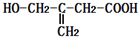 ,该有机物不可能发生的化学反应是( )
,该有机物不可能发生的化学反应是( )| A. | 还原 | B. | 水解 | C. | 氧化 | D. | 取代 |
5.下列说法中,正确的是( )
| A. | AgI、AgCl与水混合后形成的分散系中:c(Ag+)=c(I-)>c(C1-) | |
| B. | 25℃时,在pH相等的NH4C1溶液和盐酸中,水的电离程度也相等 | |
| C. | 25℃时,将pH=11的NaOH溶液与pH=3的某弱酸HA的溶液等体积混合,混合后的溶液呈碱性 | |
| D. | 25℃时,在pH=2的H2C2O4 (一种二元弱酸)溶液与pH=12的NaOH溶液以任意比例混合后形成的溶液中,一定存在:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) |