题目内容
9.Ⅰ.某无色溶液X,由K+、NH${\;}_{4}^{+}$、Ba2+、Al3+、Fe3+、CO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$中的若干种离子组成,取该溶液进行如下实验:(如图1)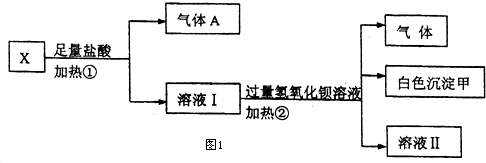
(1)白色沉淀甲是BaSO4.
(2)试写出实验过程中生成气体A、B的离子方程式CO32-+2H+=H2O+CO2↑、NH+4+OH-=NH3↑+H2O.
(3)通过上述实验,可确定X溶液中一定存在的离子是NH+4、CO32-、SO42-,要确定可能存在的离子,需补加的实验是K+.
Ⅱ.A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO${\;}_{4}^{2-}$、OH- |
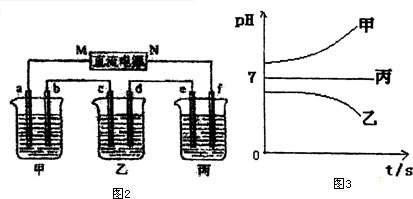
接通电源,经过一段时间后,测得乙中c电极质量增加了16g.常温下各烧杯中溶液的pH与电解时间t的关系图如图3.据此回答下列问题:
(1)M为电源的负极(填写“正”或“负”)电极b上发生的电极反应为4OH--4e-=O2↑+2H2O.
(2)计算电极e上生成的气体在标准状况下的体积5.6L;
(3)写出乙烧杯的电解池反应2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4.
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?
(5)若经过一段时间后,测得乙中c电极质量增加了16g,要使丙恢复到原来的状态,操作是加入4.5g水.
分析 Ⅰ.无色溶液,判断Fe3+不存在,加过量盐酸生成气体和溶液,判断溶液中一定含CO32-;则一定不含有Ba2+、Al3+;气体A为CO2;溶液I加入过量氢氧化钡反应生成气体B为氨气,白色沉淀甲是硫酸钡;
Ⅱ.测得乙中c电极质量增加了16g,则乙中含有Cu2+,结合离子的共存可知,B为CuSO4,丙中pH不变,则C为硫酸钠或硫酸钾,甲中pH增大,则A为KOH或NaOH,
(1)乙中c电极铜离子得电子,则c为阴极,即M为电源负极,则b为阳极,碱溶液中OH-放电;
(2)e电极上氢离子放电生成氢气,利用Cu~2e-~H2↑来计算;
(3)乙烧杯中为惰性电极电解硫酸铜溶液;
(4)B溶液中的金属离子全部析出,电解质为硫酸,能电解;
(5)丙中电解质为硫酸钠或硫酸钾,实质为电解水.
解答 解:Ⅰ.无色溶液,判断Fe3+不存在,加过量盐酸生成气体和溶液,判断溶液中一定含CO32-;则一定不含有Ba2+、Al3+;气体A为CO2;溶液I加入过量氢氧化钡反应生成气体B为氨气,一定有铵根离子,白色沉淀甲是硫酸钡,原溶液一定含有硫酸根.
(1)白色沉淀甲是硫酸钡,故答案为:BaSO4;
(2)碳酸钠溶液与过量稀盐酸混合完全反应生成CO2,反应的离子方程式为CO32-+2H+=H2O+CO2↑,铵盐能与碱反应生成氨气:NH+4+OH-=NH3↑+H2O,故答案为:CO32-+2H+=H2O+CO2↑;NH+4+OH-=NH3↑+H2O;
(3)X溶液中一定存在的离子是NH+4、CO32-、SO2-4,一定不存在的离子是Fe3+、Ba2+、Al3+,尚未确定是否存在的离子是K+,故答案为:NH+4、CO32-、SO2-4;K+;
Ⅱ.测得乙中c电极质量增加了16g,则乙中含有Cu2+,结合离子的共存可知,B为CuSO4,丙中pH不变,则C为硫酸钠或硫酸钾,甲中pH增大,则A为KOH或NaOH,
(1)乙中c电极铜离子得电子,则c为阴极,即M为电源负极,则b为阳极,碱溶液中OH-放电,电极反应为4OH--4e-=O2↑+2H2O,故答案为:负;4OH--4e-=O2↑+2H2O;
(2)e电极上氢离子放电生成氢气,n(Cu)=$\frac{16g}{64g/mol}$=0.25mol,由Cu~2e-~H2↑可知生成标况下氢气的体积为0.25mol×22.4L/mol=5.6L,故答案为:5.6L;
(3)乙烧杯中为惰性电极电解硫酸铜溶液,总反应为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,
故答案为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4;
(4)B溶液中的金属离子全部析出,电解质为硫酸,电解时溶液中的氢离子、氢氧根离子放电,能继续电解,
故答案为:能;因为CuSO4溶液已转变为H2SO4溶液,反应变为电解水的反应;
(5)丙中电解质为硫酸钠或硫酸钾,实质为电解水,由电子守恒可知H2O~2e-~Cu,则要恢复原状,加0.25mol×18g/mol=4.5g水,故答案为:加入4.5g水.
点评 本题考查了离子检验的方法应用、电解原理,明确发生的电极反应、电解反应及图象的分析是解答本题的关键,注意利用乙推出各物质及电源的正负极是解答的突破口,题目难度中等.

(1)Si位于元素周期表第三周期第ⅣA族;Fe的基态原子外围电子层排布式为3d64s2.
(2)用“>”或“<”或元素符号填空:
| C、O、Si第一电离能 | 离子半径Cl-、Na+、O2- | 熔点 | 电负性 |
| Si<C<O | Cl->O2->Na+ | CO2<SiO2 | Cl>Si |
(4)FeO42- 具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生.该反应的离子方程式为4 FeO42-+20 H+=4Fe3++3O2↑+10H2O.
| A. | 用热的纯碱溶液可洗涤餐具上的油污 | |
| B. | 新制Cu(OH)2悬浊液在医院中常用于尿糖的检测 | |
| C. | 用灼烧并闻气味的方法可区别棉麻织物和纯羊毛织物 | |
| D. | 煤经过气化和液化等物理变化可以转化为清洁燃料 |
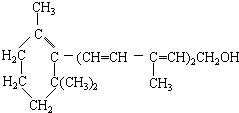
| A. | 维生素A分子含有氢原子数为奇数 | |
| B. | 维生素A的分子中含有苯环结构 | |
| C. | 1mol维生素A在催化剂作用下,可以和5molH2完全加成 | |
| D. | 维生素A属于醇,是一种水溶性维生素,可以发生消去反应 |
| A. | 醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b | |
| B. | 在滴有酚酞溶液的氨水里,加入NH4C1至溶液恰好无色,则此时溶液的pH<7 | |
| C. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合,c(CH3COO-)+2c(OH-)═2c(H+)+c(CH3COOH) | |
| D. | pH=5.6的CH3COOH与CH3COONa混合溶液中,c(CH3COO-)<c(Na+) |
①NH4Cl与NaOH ②NH4Cl与HCl ③NH4Cl与NaCl ④NH4Cl与NaHCO3
下列各项正确的是( )
| A. | PH大小顺序①>④>③>② | |
| B. | C(NH3•H2O)大小顺序:②>④>③>① | |
| C. | 混合溶液④中存在C(NH3•H2O)+C(CO32-)+C(H+)=C(OH-)+C(H2CO3) | |
| D. | 混合溶液③中水的电离被促进,其中C(H+)和C(OH-)均大于1.0×10-7mol/L |
| A. | 硝酸电离出的H+离子,能被Zn、Fe等金属还原成H2 | |
| B. | 浓HNO3与浓HCl按3:1的体积比所得的混合物叫王水 | |
| C. | 硝酸与金属反应时,主要是+5价的氮元素得电子 | |
| D. | 常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
 (1)铬的外围电子排布式是3d54s1,与铬同周期,最外层有3个未成对电子数的元素名称是砷,该元素对应的最低价氢化物分子的中心原子采取
(1)铬的外围电子排布式是3d54s1,与铬同周期,最外层有3个未成对电子数的元素名称是砷,该元素对应的最低价氢化物分子的中心原子采取