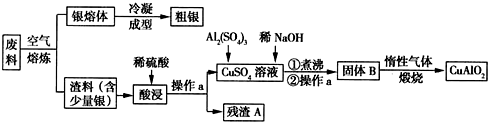
题目内容
18.常温下的4种混合溶液,分别由等体积0.1mol/L的2种溶液混合而成①NH4Cl与NaOH ②NH4Cl与HCl ③NH4Cl与NaCl ④NH4Cl与NaHCO3
下列各项正确的是( )
| A. | PH大小顺序①>④>③>② | |
| B. | C(NH3•H2O)大小顺序:②>④>③>① | |
| C. | 混合溶液④中存在C(NH3•H2O)+C(CO32-)+C(H+)=C(OH-)+C(H2CO3) | |
| D. | 混合溶液③中水的电离被促进,其中C(H+)和C(OH-)均大于1.0×10-7mol/L |
分析 A、根据铵根离子的水解程度来确定溶液酸碱性的强弱.
B、①NH4Cl与NaOH反应生成氯化钠和一水合氨,②NH4Cl中铵根离子水解生成一水合氨,盐酸抑制其水解,③氯化钠对铵根离子的水解无影响,④碳酸氢钠对铵根离子水解起到促进作用;
C、混合溶液中的守恒思想来回答;
D、③中NH4Cl的水解促进水的电离.
解答 解:A、①NH4Cl与NaOH反应生成氯化钠和一水合氨,一水合氨电离导致溶液显示碱性,碱性最强,②NH4Cl与 HCl混合液显示酸性,③氯化钠对铵根离子的水解无影响,铵根水解显示酸性,④醋酸铵溶液的PH=7,所以醋酸根离子和铵根离子水解程度相同,碳酸氢根水解程度大于铵根的水解程度,溶液显示碱性,即C(OH-)>C(H+),所以PH大小顺序为:①>④>③>②,故A正确;
B、①NH4Cl与NaOH反应生成等浓度的氯化钠和一水合氨,②NH4Cl中铵根离子水解生成一水合氨,盐酸抑制其水解,③NH4Cl中铵根离子水解生成一水合氨,氯化钠对铵根离子的水解无影响,④NH4Cl中铵根离子水解生成一水合氨,碳酸氢钠对铵根离子水解起到促进作用,所以一水合氨的浓度大小顺序是:①>④>②>③,故B错误;
C、NH4Cl与 NaHCO3 的混合溶液中,C(HCO3-)+2C(CO32-)+C(OH-)+C(Cl-)=C(H+)+C(Na+)+C(NH4+),C(NH4+)+C(NH3•H2O)=C(Cl-),C(HCO3-)+C(CO32-)+C(H2CO3)=C(Na+),且C(Cl-)=C(Na+),联立以上等式可得:C(NH3•H2O)+C(CO32-)+C(OH-)=C(H+)+C(H2CO3),故C错误;
D、③中NH4Cl水解结合了水电离出的OH-,对水的电离有促进作用,故溶液中的氢离子的浓度大于10-7mol/L,但由于OH-被结合,故溶液中氢氧根的浓度小于10-7mol/L,故D错误.
故选A.
点评 本题是一道关于离子浓度大小比较以及离子浓度之间关系知识的综合题,涉及盐的水解规律、弱电解质的电离平衡等方面的知识,综合性较强,难度大.

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案| A. | 强氧化性 | B. | 脱水性 | C. | 酸性 | D. | 吸水性 |
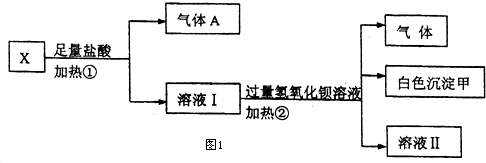
(1)白色沉淀甲是BaSO4.
(2)试写出实验过程中生成气体A、B的离子方程式CO32-+2H+=H2O+CO2↑、NH+4+OH-=NH3↑+H2O.
(3)通过上述实验,可确定X溶液中一定存在的离子是NH+4、CO32-、SO42-,要确定可能存在的离子,需补加的实验是K+.
Ⅱ.A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO${\;}_{4}^{2-}$、OH- |
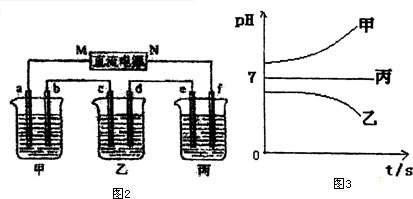
接通电源,经过一段时间后,测得乙中c电极质量增加了16g.常温下各烧杯中溶液的pH与电解时间t的关系图如图3.据此回答下列问题:
(1)M为电源的负极(填写“正”或“负”)电极b上发生的电极反应为4OH--4e-=O2↑+2H2O.
(2)计算电极e上生成的气体在标准状况下的体积5.6L;
(3)写出乙烧杯的电解池反应2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4.
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?
(5)若经过一段时间后,测得乙中c电极质量增加了16g,要使丙恢复到原来的状态,操作是加入4.5g水.
| A. | 10L | B. | 15L | C. | 25L | D. | 27L |
2Na2S(aq)+Na2CO3(aq)+4SO2(aq)═3Na2S2O3(aq)+CO2(g)△H>0
实验小组在实验室用硫化碱法制备Na2S2O3.5SH2O流程如下:
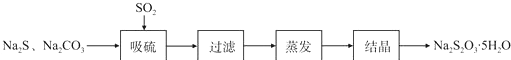
(1)吸硫装置如图所示.
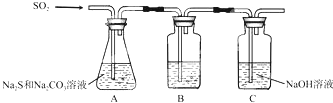
①装置B的作用是检验装置A中SO2的吸收效率,装置C的作用是吸收二氧化硫,防止污染空气
②为了提高SO2的吸收率,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外可采用合理的措施是
增大SO2的接触面积、控制SO2的流速、适当升高温度等(写出两条)
③假设本实验所用的Na2CO3含少量NaCl、NaOH,设计实验方案进行检验
已知:室温时BaCO3饱和溶液的pH=9.6)限选试剂及仪器:稀硝酸、AgNO3溶液、BaCl2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解 滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡 | 有白色沉淀生成 | 样品含NaCl |
| ② | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解 加入过量BaCl2溶液,搅拌,静置,用pH计测定上层清液pH | 有白色沉淀生成,上层清液pH大于9.6 | 样品含NaOH |
已知:IO3+5I+6H+═3I2+3H2O 2S2O32-+I2═S4O62-+2I-.
| 选项 | 叙述 | 评价 |
| A | 乙酸乙酯在H218 O中水解,产物乙醇中将含有18O | 错,根据酯的水解规律,产物乙酸中将含有18O同位素,而乙醇则没有. |
| B | 淀粉与20%的硫酸混合溶液在沸水浴中充分加热后滴加碘水无蓝色现象,则说明淀粉水解完全 | 错,淀粉水解后未加碱中和至溶液呈碱性. |
| C | 向卤代烃水解后的溶液中加入AgNO3溶液,根据沉淀颜色可以判断卤素原子种类 | 对,水解后溶液中有卤化氢,与AgNO3溶液反应生成卤化银沉淀. |
| D | 可以用新制的Cu(OH)2悬浊液鉴别乙醇溶液、乙酸溶液和葡萄糖溶液 | 错,用新制的Cu(OH)2悬浊液不能鉴别乙醇溶液和乙酸溶液. |
| A. | A | B. | B | C. | C | D. | D |