题目内容
4.将0.1L含有0.02mol CuSO4和0.01molNaCl的水溶液用惰性电极电解.电解一段时间后,一个电极上得到0.01mol Cu,(1)另一电极析出的气体的成分及相应质量为既有0.355gCl2又有0.08gO2.
(2)所得溶液的PH减小(填增大或减小)c(H+)=0.1mol/L.
分析 (1)电解硫酸铜和氯化钠混合溶液时,阴极上铜离子先放电,然后氢离子放电,阳极上氯离子先放电,然后氢氧根离子放电,若在一个电极上得到0.01mol Cu,根据转移电子守恒判断另一电极上生成气体成分及生成气体的物质的量,再根据m=nM计算生成气体质量;
(2)根据氧气和氢离子之间的关系式计算氢离子的物质的量,再根据c=$\frac{n}{V}$计算.
解答 解:(1)电解硫酸铜和氯化钠混合溶液时,阴极上铜离子先放电,然后氢离子放电,阳极上氯离子先放电,然后氢氧根离子放电,若在一个电极上得到0.01mol Cu,转移电子的物质的量=0.01mol×2=0.02mol,
阳极上0.01mol氯离子放电转移电子的物质的量=0.01mol×1=0.01mol<0.02mol,所以阳极上还有氢氧根离子放电,转移0.01mol电子生成氧气的物质的量=$\frac{0.01mol}{4}$=0.0025mol,所以生成氯气的质量=$\frac{0.01}{2}$×71=0.355g,生成氧气的质量为0.0025×32=0.08g,故答案为:既有0.355gCl2又有0.08gO2;
(2)阳极上氢氧根离子放电时生成氢离子,实际上是电解硫酸铜溶液,2H2O+2Cu$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+,
根据(1)知,生成氧气的物质的量0.0025mol,根据氧气和氢离子之间的关系式得n(H+)=4n(O2)
=0.01mol,c(H+)=$\frac{0.01mol}{0.1L}$=0.1mol/L,所以pH减小,
故答案为:减小;0.1mol/L;
点评 本题考查了电解原理,明确离子放电顺序是解本题关键,结合转移电子守恒确定阳极上放电的离子,根据物质之间的关系式来分析解答,难度中等.


| A. | a为正极,b为负极 | |
| B. | 生产过程中a电极质量减轻 | |
| C. | 电子从b极向a极移动 | |
| D. | 负极反应式为:SO2+2H2O-2e-=SO42-+4H+ |
| A. | 盛放待测液的锥形瓶使用前未用待测液润洗 | |
| B. | 用酚酞作指示剂,配制好的碱溶液在空气中吸收了少量二氧化碳气体 | |
| C. | 锥形瓶中颜色由红色变无色,马上记录终点读数,但半分钟不到,溶液又恢复红色 | |
| D. | 读标准酸液初始体积时俯视,终点时平视读数 |
| A. | N2是还原产物,CO2是氧化产物 | |
| B. | 每生成22.4LCO2需转移3 mol电子 | |
| C. | 反应中氧化剂和还原剂的物质的量之比为4:3 | |
| D. | N元素既被氧化,也被还原 |
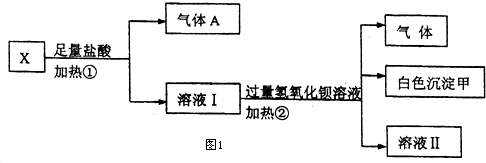
(1)白色沉淀甲是BaSO4.
(2)试写出实验过程中生成气体A、B的离子方程式CO32-+2H+=H2O+CO2↑、NH+4+OH-=NH3↑+H2O.
(3)通过上述实验,可确定X溶液中一定存在的离子是NH+4、CO32-、SO42-,要确定可能存在的离子,需补加的实验是K+.
Ⅱ.A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO${\;}_{4}^{2-}$、OH- |
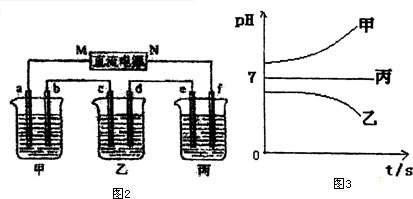
接通电源,经过一段时间后,测得乙中c电极质量增加了16g.常温下各烧杯中溶液的pH与电解时间t的关系图如图3.据此回答下列问题:
(1)M为电源的负极(填写“正”或“负”)电极b上发生的电极反应为4OH--4e-=O2↑+2H2O.
(2)计算电极e上生成的气体在标准状况下的体积5.6L;
(3)写出乙烧杯的电解池反应2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4.
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?
(5)若经过一段时间后,测得乙中c电极质量增加了16g,要使丙恢复到原来的状态,操作是加入4.5g水.
| A. | 已知PM2.5是指大气中直径≤2.5×10-6m的颗粒物,则PM为2.5的大气一定能产生丁达尔现象 | |
| B. | 为提高农作物的产量和质量,应大量使用化肥和农药 | |
| C. | ${\;}_{1}^{2}$H、${\;}_{1}^{3}$H是制造氢弹的原料,它们是同一种核素 | |
| D. | 太阳能电池可采用硅材料制作,其应用有利于环保、节能 |
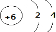 E的电子式为
E的电子式为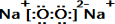 ;
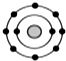
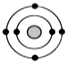
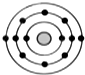
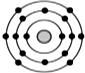
;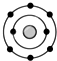 某元素原子的核外电子排布示意图如图所示,下列原子中,与该元素原子的化学性质相似的是( )
某元素原子的核外电子排布示意图如图所示,下列原子中,与该元素原子的化学性质相似的是( )