题目内容
18.关于硝酸的说法正确的是( )| A. | 硝酸电离出的H+离子,能被Zn、Fe等金属还原成H2 | |
| B. | 浓HNO3与浓HCl按3:1的体积比所得的混合物叫王水 | |
| C. | 硝酸与金属反应时,主要是+5价的氮元素得电子 | |
| D. | 常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
分析 A.硝酸具有强氧化性,与金属反应不产生氢气;
B.浓HNO3与浓HCl按1:3体积比所得的混合物叫王水;
C.硝酸为氧化性酸,与金属反应时,硝酸根表现强的氧化性;
D.浓硝酸具有强的氧化性,常温下遇Fe片发生钝化.
解答 解:A.硝酸具有强氧化性,与金属反应不产生氢气,故A错误;
B.浓HNO3与浓HCl按1:3体积比所得的混合物叫王水,故B错误;
C.硝酸为氧化性酸,与金属反应时,硝酸根表现强的氧化性,故C正确;
D.常温下,向浓HNO3中投入Fe片,发生钝化,不会产生大量的红棕色气体,故D错误.
故选C.
点评 本题考查了硝酸的性质,把握硝酸具有强的氧化性,是氧化性酸是解题关键,注意王水的组成.

练习册系列答案
相关题目
9.Ⅰ.某无色溶液X,由K+、NH${\;}_{4}^{+}$、Ba2+、Al3+、Fe3+、CO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$中的若干种离子组成,取该溶液进行如下实验:(如图1)
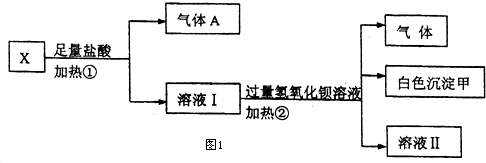
(1)白色沉淀甲是BaSO4.
(2)试写出实验过程中生成气体A、B的离子方程式CO32-+2H+=H2O+CO2↑、NH+4+OH-=NH3↑+H2O.
(3)通过上述实验,可确定X溶液中一定存在的离子是NH+4、CO32-、SO42-,要确定可能存在的离子,需补加的实验是K+.
Ⅱ.A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
如图2所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A溶液、足量的B溶液、足量的C溶液,电极均为石墨电极.
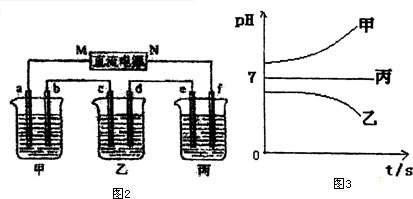
接通电源,经过一段时间后,测得乙中c电极质量增加了16g.常温下各烧杯中溶液的pH与电解时间t的关系图如图3.据此回答下列问题:
(1)M为电源的负极(填写“正”或“负”)电极b上发生的电极反应为4OH--4e-=O2↑+2H2O.
(2)计算电极e上生成的气体在标准状况下的体积5.6L;
(3)写出乙烧杯的电解池反应2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4.
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?
(5)若经过一段时间后,测得乙中c电极质量增加了16g,要使丙恢复到原来的状态,操作是加入4.5g水.

(1)白色沉淀甲是BaSO4.
(2)试写出实验过程中生成气体A、B的离子方程式CO32-+2H+=H2O+CO2↑、NH+4+OH-=NH3↑+H2O.
(3)通过上述实验,可确定X溶液中一定存在的离子是NH+4、CO32-、SO42-,要确定可能存在的离子,需补加的实验是K+.
Ⅱ.A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO${\;}_{4}^{2-}$、OH- |

接通电源,经过一段时间后,测得乙中c电极质量增加了16g.常温下各烧杯中溶液的pH与电解时间t的关系图如图3.据此回答下列问题:
(1)M为电源的负极(填写“正”或“负”)电极b上发生的电极反应为4OH--4e-=O2↑+2H2O.
(2)计算电极e上生成的气体在标准状况下的体积5.6L;
(3)写出乙烧杯的电解池反应2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4.
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行,为什么?
(5)若经过一段时间后,测得乙中c电极质量增加了16g,要使丙恢复到原来的状态,操作是加入4.5g水.
7.下列叙述及评价均合理的是( )
| 选项 | 叙述 | 评价 |
| A | 乙酸乙酯在H218 O中水解,产物乙醇中将含有18O | 错,根据酯的水解规律,产物乙酸中将含有18O同位素,而乙醇则没有. |
| B | 淀粉与20%的硫酸混合溶液在沸水浴中充分加热后滴加碘水无蓝色现象,则说明淀粉水解完全 | 错,淀粉水解后未加碱中和至溶液呈碱性. |
| C | 向卤代烃水解后的溶液中加入AgNO3溶液,根据沉淀颜色可以判断卤素原子种类 | 对,水解后溶液中有卤化氢,与AgNO3溶液反应生成卤化银沉淀. |
| D | 可以用新制的Cu(OH)2悬浊液鉴别乙醇溶液、乙酸溶液和葡萄糖溶液 | 错,用新制的Cu(OH)2悬浊液不能鉴别乙醇溶液和乙酸溶液. |
| A. | A | B. | B | C. | C | D. | D |
8.x、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知( )
| A. | x的原子序数大于y的原子序数 | |
| B. | x的电负性小于y的电负性 | |
| C. | x的离子半径大于y的离子半径 | |
| D. | x的第一电离能小于y 的第一电离能 |
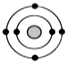
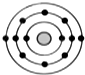
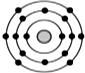
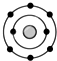 某元素原子的核外电子排布示意图如图所示,下列原子中,与该元素原子的化学性质相似的是( )
某元素原子的核外电子排布示意图如图所示,下列原子中,与该元素原子的化学性质相似的是( )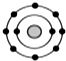


 .
. 按1:1恰好反应生成两种酸性有机物,则另一种有机物的名称为乙酸.
按1:1恰好反应生成两种酸性有机物,则另一种有机物的名称为乙酸. .试剂c最好选用C(填字母序号).
.试剂c最好选用C(填字母序号). .
.