题目内容
6.下列事实中,不能用勒夏特列原理加以解释的是( )| A. | 夏天,打开啤酒瓶时会在瓶口逸出气体 | |
| B. | 浓氨水中加入氢氧化钠固体时产生较多的刺激性气味的气体 | |
| C. | 压缩氢气与碘蒸气反应的平衡混合气体,颜色变深 | |
| D. | 将盛有二氧化氮和四氧化二氮混合气的密闭容器置于冷水中,混合气体颜色变浅 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A.因溶液中存在二氧化碳的溶解平衡,开启啤酒瓶后,压强减小,二氧化碳逸出,能用勒夏特列原理解释,故A不选;
B.浓氨水中存在平衡NH3+H2O?NH3•H2O?NH4++OH-,加入氢氧化钠固体时,平衡会向逆向移动,会产生较多的刺激性气味的气体,能用勒夏特利原理解释,故B不选;
C.氢气与碘蒸气反应的平衡中,前后气体系数和是相等的,压强对平衡无影响,压缩气体,碘单质的浓度增大,颜色加深,不能用勒夏特利原理解释,故C选;
D.二氧化氮和四氧化二氮混合气体的密闭容器置于冷水中,化学平衡向着生成四氧化二氮的方向进行,颜色变浅,能用勒夏特利原理解释,故D不选;
故选C.
点评 本题考查化学平衡移动原理,为高频考点,明确化学平衡移动原理内涵及适用范围是解本题关键,注意:化学平衡移动原理只适用于“改变条件时能引起化学平衡移动的可逆反应”,易错选项是C,题目难度不大.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
17.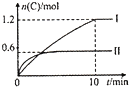 在2L的恒容密闭容器中,发生反应:A(g)+B(g)?2C(g)+D(s)△H=-akJ.mol-1,实验内容和结果分别如下表和如图所示.下列说法正确的是( )
在2L的恒容密闭容器中,发生反应:A(g)+B(g)?2C(g)+D(s)△H=-akJ.mol-1,实验内容和结果分别如下表和如图所示.下列说法正确的是( )
 在2L的恒容密闭容器中,发生反应:A(g)+B(g)?2C(g)+D(s)△H=-akJ.mol-1,实验内容和结果分别如下表和如图所示.下列说法正确的是( )
在2L的恒容密闭容器中,发生反应:A(g)+B(g)?2C(g)+D(s)△H=-akJ.mol-1,实验内容和结果分别如下表和如图所示.下列说法正确的是( )| 实验 | 温度 | 起始物质的量 | 热量 | |
| 序号 | A | B | 变化 | |
| I | 600℃ | 1mol | 3mol | 96 kJ |
| n | 800℃ | 0.5mol | 1.5mol | ---- |
| A. | 实验I中,10min内平均速率v(B)=0.06mol.L-1•min-1 | |
| B. | 上述方程式中a=160 | |
| C. | 600℃时,该反应的平衡常数是0.45 | |
| D. | 向实验E的平衡体系中再充入0.5molA和1.5molB,A的转化率不变 |
14.化学无处不在,如图是物质间发生化学反应的颜色变化,其中X是( )

| A. | 稀盐酸 | B. | 稀硫酸 | C. | 氯化铁溶液 | D. | 碳酸钠溶液 |
1.化学实验必须注意安全,下列做法正确的是( )
| A. | 制取乙酸乙酯时,先将1体积的酒精倒入3体积的浓硫酸中 | |
| B. | 配置银氨溶液时,将稀氨水滴加到硝酸银溶液中至沉淀恰好溶解为止 | |
| C. | 实验室做钠与乙醇的实验时,余下的钠屑投入到废液缸中 | |
| D. | 制硝基苯时,直接把盛有混合液的试管在酒精灯的外焰处加热 |
11.某温度下,在体积可变的密闭容器中,加入1molX(g)和3molY(g)发生反应达到平衡:X(g)+m Y(g)═3Z(g),在此平衡体系中加入3molZ(g),再次达到平衡后,X、Y、Z的体积分数不变.下列叙述不正确的是( )
| A. | m=3 | |
| B. | 两次平衡的平衡常数相同 | |
| C. | X与Y的平衡转化率之比为1:1 | |
| D. | 第二次平衡时,Z的浓度为原平衡的2倍 |
18.欲用滴加试剂乙来检验溶液中是否同时含有离子X和离子Y,则下表所列四种情况下的检验能够成功的是
( )
( )
| 试剂乙 | 离子X | 离子Y | |
| A | HCl | SO42- | S2O32- |
| B | AgNO3 | Cl- | CO32- |
| C | NH4SCN | Fe2+ | Fe3+ |
| D | NH3•H2O | Al3+ | Ag+ |
| A. | A | B. | B | C. | C | D. | D |
15.铝可以做成反光镜,这是利用了铝的( )
| A. | 具有金属光泽 | B. | 延展性 | C. | 导热性 | D. | 金属活泼性 |
16.分类方法在化学学科的发展中起到重要的作用,下列分类标准合理的是( )
| A. | 根据碳酸钠溶于水呈碱性,碳酸钠既属于盐,又属于碱 | |
| B. | 根据物质是否能导电,将物质分为电解质、非电解质 | |
| C. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 | |
| D. | 根据化学反应过程中元素化合价是否发生变化,将化学反应分为氧化还原反应和非氧化还原反 应 |