题目内容
3.将0.2mol KMnO4在一定温度下加热后生成a mol O2(a≠0);将剩余固体与过量浓盐酸混合加热又生成b mol Cl2,此时锰元素均以Mn2+形式存在.若a+b=m,则m的取值范围为0.4≤m≤0.5.分析 将0.2mol KMnO4在一定温度下加热,反应方程式为2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,剩余固体与过量浓盐酸混合加热又生成氯气,反应过程中锰元素得到的电子数等于O元素、Cl元素失去的电子数,根据得失电子守恒结合极值法计算m值.
解答 解:在氧化还原反应中得失电子数相等,所以反应过程中锰元素得到的电子数等于O元素、Cl元素失去的电子数,
所以0.2mol×(7-2)=4amol+2bmol,即1=4a+2b,则2a+b=0.5,已知a+b=m,
所以a+b=m=0.5-a,
当高锰酸钾不分解生成氧气时,a=0,当高锰酸钾完全分解生成氧气时,生成氧气的物质的量为0.1mol,所以a的取值范围为0≤a≤0.1,
则0.5-0.1≤m≤0.5-0,即0.4≤m≤0.5,
故答案为:0.4≤m≤0.5.
点评 本题考查氧化还原反应的有关计算,根据电子守恒结合极值法进行分析解答即可,难度较大.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
13.N20俗称“笑气”,医疗上曾用作可吸入性麻醉剂,下列反应能产生N20:3C0+2N02=3C02+N2O.下列关于N20的说法一定正确的是( )
| A. | 上述反应中,每消耗2mol NO2,就会生成22.4L N20 | |
| B. | N20有氧化性,且为HN02的酸酐 | |
| C. | 等质量的N20和C02含有相等的电子数 | |
| D. | N20会迅速与人体血红蛋白结合,使人中毒 |
8.下列离子反应方程式正确的是( )
| A. | 向溶Ca(ClO)2液中通入少量SO2:Ca2++3ClO-+SO2 +H2O═CaSO4 ↓+Cl-+2HClO | |
| B. | 1mol/L的NaAlO2 溶液和2.5mol/L的盐酸等体积均匀混合:2AlO2-+5H+═A l(OH)3 ↓+Al3++H2O | |
| C. | 将11.2L标准状况下的氯气通入200mL 2mol/LFeBr2 的溶液中,离子反应方程式为:2Fe2++8Br-+5Cl2 ═2Fe3++4Br2 +10Cl- | |
| D. | 氢氧化亚铁溶于稀硝酸中:Fe(OH)2 +2H+═Fe2++H2O |
15.下列叙述中,正确的是( )
| A. | 含金属元素的离子一定都是阳离子 | |
| B. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| C. | 金属元素从化合态变为游离态,该元素一定被还原 | |
| D. | 金属阳离子被还原一定得到金属单质 |
5.苯甲酸甲酯是一种重要的工业原料,某化学小组采用如图装置,以苯甲酸、甲醇为原料制取苯甲酸甲酯.有关物质的物理性质见下表所示: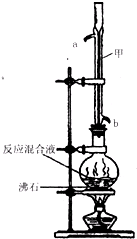
Ⅰ合成苯甲酸甲酯粗产品
在圆底烧瓶中加入0.1mol苯甲酸和0.4mol甲醇,再小心加入3mL浓硫酸,混匀后,投入几粒沸石,小心加热使反应完全,得苯甲酸甲酯粗产品.
甲装置的作用是:冷凝回流;冷却水从b(填“a”或“b”)口进入.
Ⅱ粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制.
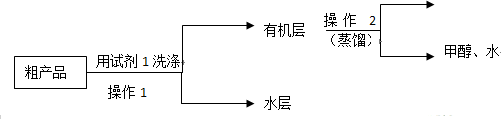
(1)试剂1可以是B(填编号),作用是洗去苯甲酸甲酯中过量的酸.
A.稀硫酸 B.饱和碳酸钠溶液 C.乙醇
(2)操作2中,收集产品时,控制的温度应在199.6℃左右.
(3)实验制得的苯甲酸甲酯精品质量为10g,则苯甲酸的转化率为73.5%.(结果保留三位有效数字)

| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/℃ | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
在圆底烧瓶中加入0.1mol苯甲酸和0.4mol甲醇,再小心加入3mL浓硫酸,混匀后,投入几粒沸石,小心加热使反应完全,得苯甲酸甲酯粗产品.
甲装置的作用是:冷凝回流;冷却水从b(填“a”或“b”)口进入.
Ⅱ粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制.

(1)试剂1可以是B(填编号),作用是洗去苯甲酸甲酯中过量的酸.
A.稀硫酸 B.饱和碳酸钠溶液 C.乙醇
(2)操作2中,收集产品时,控制的温度应在199.6℃左右.
(3)实验制得的苯甲酸甲酯精品质量为10g,则苯甲酸的转化率为73.5%.(结果保留三位有效数字)
6.下列事实中,不能用勒夏特列原理加以解释的是( )
| A. | 夏天,打开啤酒瓶时会在瓶口逸出气体 | |
| B. | 浓氨水中加入氢氧化钠固体时产生较多的刺激性气味的气体 | |
| C. | 压缩氢气与碘蒸气反应的平衡混合气体,颜色变深 | |
| D. | 将盛有二氧化氮和四氧化二氮混合气的密闭容器置于冷水中,混合气体颜色变浅 |