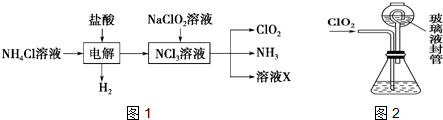
题目内容
17.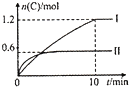 在2L的恒容密闭容器中,发生反应:A(g)+B(g)?2C(g)+D(s)△H=-akJ.mol-1,实验内容和结果分别如下表和如图所示.下列说法正确的是( )
在2L的恒容密闭容器中,发生反应:A(g)+B(g)?2C(g)+D(s)△H=-akJ.mol-1,实验内容和结果分别如下表和如图所示.下列说法正确的是( )| 实验 | 温度 | 起始物质的量 | 热量 | |
| 序号 | A | B | 变化 | |
| I | 600℃ | 1mol | 3mol | 96 kJ |
| n | 800℃ | 0.5mol | 1.5mol | ---- |
| A. | 实验I中,10min内平均速率v(B)=0.06mol.L-1•min-1 | |
| B. | 上述方程式中a=160 | |
| C. | 600℃时,该反应的平衡常数是0.45 | |
| D. | 向实验E的平衡体系中再充入0.5molA和1.5molB,A的转化率不变 |
分析 A.图象分析可知实验Ⅰ中,10 min内C生成了1.2mol,结合化学反应速率v=$\frac{△c}{△t}$计算,速率之比等于化学方程式计量数之比,以此计算B的反应速率;
B.根据图象中的变化量结合图表中热量变化计算,依据化学平衡三段式可知,
A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1,
起始量(mol) 1 3 0 0 akJ
变化量(mol) 0.6 0.6 1.2 0.6 96kJ
平衡量(mol) 0.4 2.4 1.2 0.6
反应焓变是指1molA全部反应的热量变化;
C.结合B中化学平衡三段式列式计算平衡浓度,c(A)=0.2mol/L,c(B)=1.2mol/L,c(C)=0.6mol/L,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;
D.反根据等效平衡分析判断,反应前后气体体积不变,等比等效,开始投入量 AB之比为3:1,向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,可以看作充入AB反应比为3:1,先投入0.5molA和$\frac{0.5}{3}$molB,达到平衡状态,A的转化率不变,相当于多投入1.5mol-$\frac{0.5}{3}$molB的量.
解答 解:图象分析,先拐先平温度高,温度越高C物质的量越小,温度升高,平衡逆向进行,说明反应是放热反应,
A.10 min内C生成了1.2mol,则反应速率v(C)=$\frac{\frac{1.2}{2}}{10}$0.06mol/L•min=0.06mol/L•min,速率之比等于化学方程式计量数之比,v(B)=$\frac{1}{2}$v(C)=0.06mol/L•min×$\frac{1}{2}$=0.03mol/L•min,故A错误;
B.由化学平衡三段式可知,
A(g)+B(g)?2C(g)+D(s)△H=a kJ•mol-1,
起始量(mol) 1 3 0 0 aKJ
变化量(mol) 0.6 0.6 1.2 0.6 96KJ
平衡量(mol) 0.4 2.4 1.2 0.6
反应焓变是指1molA全部反应的热量变化,则a=$\frac{96kJ}{0.6mol}$=160kJ/mol
图象分析,先拐先平温度高,温度越高C物质的量越小,温度升高,平衡逆向进行,说明反应是放热反应,所以a=-160,故B正确;
C.由B中可知平衡浓度:c(A)=0.2mol/L,c(B)=1.2mol/L,c(C)=0.6mol/L,平衡常数K=$\frac{0.{6}^{2}}{0.2×1.2}$=1.5,故C错误;
D.反应前后气体体积不变,等比等效,开始投入量 AB之比为1:3,向实验Ⅱ的平衡体系中再充入0.5 mol A和1.5 mol B,可以看作先投入0.5molA和1.5molB后再投入0.5molA和1.5molB,达到相同平衡状态,A的转化率不变,故D正确;
故选BD.
点评 本题考查化学平衡计算,为高频考点,侧重考查学生分析计算能力,会利用三段式法进行解答,难点是D选项中等效平衡的建立,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 含金属元素的离子一定都是阳离子 | |
| B. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| C. | 金属元素从化合态变为游离态,该元素一定被还原 | |
| D. | 金属阳离子被还原一定得到金属单质 |
| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/℃ | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
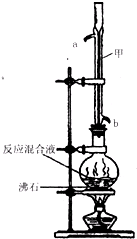
在圆底烧瓶中加入0.1mol苯甲酸和0.4mol甲醇,再小心加入3mL浓硫酸,混匀后,投入几粒沸石,小心加热使反应完全,得苯甲酸甲酯粗产品.
甲装置的作用是:冷凝回流;冷却水从b(填“a”或“b”)口进入.
Ⅱ粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制.
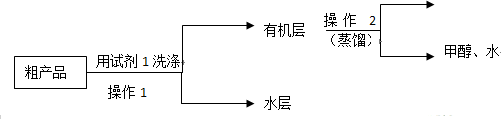
(1)试剂1可以是B(填编号),作用是洗去苯甲酸甲酯中过量的酸.
A.稀硫酸 B.饱和碳酸钠溶液 C.乙醇
(2)操作2中,收集产品时,控制的温度应在199.6℃左右.
(3)实验制得的苯甲酸甲酯精品质量为10g,则苯甲酸的转化率为73.5%.(结果保留三位有效数字)
| A. | $\frac{1}{9}$ | B. | $\frac{1}{6}$ | C. | $\frac{2}{9}$ | D. | $\frac{1}{3}$ |
| A. | 夏天,打开啤酒瓶时会在瓶口逸出气体 | |
| B. | 浓氨水中加入氢氧化钠固体时产生较多的刺激性气味的气体 | |
| C. | 压缩氢气与碘蒸气反应的平衡混合气体,颜色变深 | |
| D. | 将盛有二氧化氮和四氧化二氮混合气的密闭容器置于冷水中,混合气体颜色变浅 |
| A. | 有单质参加或有单质生成的反应一定是氧化还原反应 | |
| B. | 金属单质参与氧化还原反应时一定作还原剂 | |
| C. | 失去电子难的原子获得电子就一定容易 | |
| D. | 含最高价元素的化合物一定具有强氧化性 |