题目内容
10.向c(H+)相等的一元酸HA和HB的溶液中分别加入适量的锌粉,充分反应后,当收集到的H2体积相等时,消耗酸的体积V(HA)>V(HB),下列分析正确的是( )| A. | 消耗锌的质量m(HA)>m(HB) | B. | HA一定是强酸 | ||
| C. | 生成H2的平均反应速率v(HA)<v(HB) | D. | 酸性:HB>HA |
分析 A.生成氢气的体积相等,根据电子守恒,消耗锌的物质的量、质量一定相等;
B.HA的酸性大于HB,但HA不一定是强酸;
C.由于HB酸性小于HA,则HB的浓度大于HA,反应过程中HB中氢离子浓度大于HA;
D.氢离子浓度相等,生成氢气相等,消耗的氢离子总物质的量相等,而消耗酸的体积V(HA)>V(HB),说明HA的酸性大于HB.
解答 解:A.根据生成氢气的量相等可知,则反应消耗的锌一定相等,即:m(HA)=m(HB),故A错误;
B.生成氢气的量相等,HA和HB提供的氢离子的总物质的量一定相等,而需要酸的体积V(HA)>V(HB),即:c(H+)相等时,提供等物质的量的氢离子,HB的物质的量必须大于HA,说明酸性HA的酸性大于HB,但是不能说明HA为强酸,故B错误;
C.根据B可知,HA酸性大于HB,则HB的物质的量浓度一定大于HA,反应过程中随着氢离子浓度减小,HB的电离程度增大,氢离子浓度大于HA,所以生成氢气的平均反应速率:V(HA)<V(HB),故C正确;
D.生成氢气的量相等,HA和HB提供的氢离子的总物质的量一定相等,而需要酸的体积V(HA)>V(HB),即:c(H+)相等时,提供等物质的量的氢离子,HB的物质的量必须大于HA,说明酸性HA的酸性大于HB,故D错误;
故选C.
点评 本题考查了弱电解质的电离平衡及其影响、金属与酸的化学反应,题目难度中等,注意掌握弱电解质的电离及影响因素,正确判断HA、HB的酸性强弱是解答本题的关键,选项B为易错点,题干信息只能得出酸性HA的酸性大于HB,无法判断HA是否为强酸.

练习册系列答案
相关题目
20.下列物质分别与NaOH的醇溶液共热后,能发生消去反应,且生成的有机物不存在同分异构体的是( )
| A. | 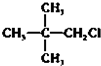 | B. |  | C. | CH3Cl | D. | 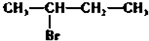 |
1.把200mL含有CaCl2和KCl的混合溶液分成2等份,取一份加入含2a mol 碳酸钠的溶液,恰好使钙离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
| A. | 0.1(b-4a) mol•L-1 | B. | 0.1(b-2a) mol•L-1 | C. | 10(b-4a) mol•L-1 | D. | 10(b-2a) mol•L-1 |
18.下列说法不正确的是( )
| A. | 废旧电池应集中回收处理 | |
| B. | 充电电池放电时,化学能转变为电能 | |
| C. | 放在冰箱中的食品保质期较长,这与温度对反应速率的影响有关 | |
| D. | 所有燃烧反应都是放热反应,所以不需吸收能量就可以进行 |
5.下表是元素周期表的一部分,表中所列的字母分别代表某一种化学元素.
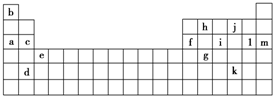
(1)上述第三周期元素中第一电离能(I1)最大的是m(用字母表示,下同),c和f的I1大小关系是c大于f.
(2)上述元素中,原子中未成对电子数最多的是i,写出该元素的电子排布式:1s22s22p63s23p3.
(3)根据下表所提供的电离能数据,回答下列问题.
①表中X可能为以上13种元素中的a元素.用元素符号表示X和j形成的化合物的化学式Na2O、Na2O2.
②Y是周期表中的ⅢA族的元素.

(1)上述第三周期元素中第一电离能(I1)最大的是m(用字母表示,下同),c和f的I1大小关系是c大于f.
(2)上述元素中,原子中未成对电子数最多的是i,写出该元素的电子排布式:1s22s22p63s23p3.
(3)根据下表所提供的电离能数据,回答下列问题.
| 锂 | X | Y | |
| I1 | 519 | 502 | 580 |
| I2 | 7296 | 4570 | 1820 |
| I3 | 11799 | 6920 | 2750 |
| I4 | 9550 | 11600 |
②Y是周期表中的ⅢA族的元素.
15.工业生产水煤气的反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.4kJ•mol-1,下列判断正确的是( )
| A. | 反应物能量总和大于生成物能量总和 | |
| B. | CO(g)+H2(g)?C(s)+H2O(l)△H=-131.4kJ•mol-1 | |
| C. | 水煤气反应中生成1molH2(g)吸收131.4 kJ热量 | |
| D. | 水煤气反应中生成1L CO(g)吸收131.4 kJ热量 |
2. 在用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是( )
在用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是( )
 在用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是( )
在用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是( )| A. | 锌片是正极,铜片上有气泡产生 | |
| B. | 电流方向是从锌片经过导线流向铜片 | |
| C. | 溶液中的阳离子向负极移动,阴离子向正极移动 | |
| D. | 当导线中有0.1mol电子通过时,铜片上产生气体1.12L(标准状况) |
19.一定温度下,在带活塞的密闭容器中,反应H2(g)+I2(g)?2HI(g)(正反应为放热反应)达到平衡后,下列说法中不正确的是( )
| A. | 恒压时,通入HI气体,刚开始时正反应速率会减小 | |
| B. | 恒温时,减小容积,平衡不移动,但气体颜色加深 | |
| C. | 恒容时,通入H2,I2的质量分数减小 | |
| D. | 恒容时,升高温度,平衡向逆反应方向移动,正反应速率减小 |