题目内容
2. 在用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是( )
在用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是( )| A. | 锌片是正极,铜片上有气泡产生 | |
| B. | 电流方向是从锌片经过导线流向铜片 | |
| C. | 溶液中的阳离子向负极移动,阴离子向正极移动 | |
| D. | 当导线中有0.1mol电子通过时,铜片上产生气体1.12L(标准状况) |
分析 在Zn片、Cu片和稀硫酸组成的电池装置中,Zn活泼作负极失电子发生氧化反应,铜为正极氢离子得电子发生还原反应生成氢气,电流由正极流向负极,阴离子向负极移动,以此来分析.
解答 解:A、锌片是负极,铜为正极氢离子得电子发生还原反应生成氢气,则铜片上有气泡产生,故A错误;
B、电流方向是从Cu片经导线流向Zn片,故B错误;
C、溶液中的阳离子向正极移动,阴离子向负极移动,故C错误;
D、因铜为正极氢离子得电子发生还原反应生成氢气,所以当导线中有0.1mol电子通过时,铜片上产生气体1.12L(标准状况),故D正确;
故选D.
点评 本题考查原电池的工作原理,明确正负极的判断、电流的方向、离子的移动方向,电极反应即可解答,难度不大.

练习册系列答案
相关题目
12.下列说法中正确的是( )
| A. | 元素性质的周期性变化是指原子半径、元素的主要化合价及原子核外电子排布的周期性变化 | |
| B. | 元素性质的周期性变化决定于元素原子结构的周期性变化 | |
| C. | 从Li→F,Na→Cl,元素的最高化合价均呈现从+1价→+7价的变化 | |
| D. | 电子总是尽量先排在能量较低的电子层,如排满了K层排L层,排满了M层排N层 |
13.在密闭容器中进行如下反应:X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol•L-1、0.3mol•L-1、0.2mol•L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A. | Z为0.3 mol•L-1 | B. | X2为0.2 mol•L-1 | ||
| C. | Y2为0.4 mol•L-1 | D. | c(X2)+c(Y2)+c(Z)=0.55 mol•L-1 |
10.向c(H+)相等的一元酸HA和HB的溶液中分别加入适量的锌粉,充分反应后,当收集到的H2体积相等时,消耗酸的体积V(HA)>V(HB),下列分析正确的是( )
| A. | 消耗锌的质量m(HA)>m(HB) | B. | HA一定是强酸 | ||
| C. | 生成H2的平均反应速率v(HA)<v(HB) | D. | 酸性:HB>HA |
17.有一含0.04molH2SO4、0.04molHNO3的混合稀溶液,加入足量的铜粉,加热充分反应,最终可产生气体的物质的量是( )
| A. | 0.01mol | B. | 0.03mol | C. | 0.04mol | D. | 0.01~0.03mol |
7.一定温度下,在体积可变的恒温密闭容器中,甲醇在浓硫酸作催化剂的条件下发生下列反应:2CH3OH(g)=CH3OCH3(g)+H2O(g)△H=-25kJ•mol-1,下列有关该反应的叙述正确的是( )
| A. | 该条件下,1 mol CH3OH(g)参加反应,放出的热量为25 kJ | |
| B. | 若不采用合适的催化剂,该反应中甲醇的转化率将降低 | |
| C. | 升高温度和增大压强(缩小容器容积)均可加快反应速率 | |
| D. | 反应过程中,2v(CH3OH)=v(CH3OCH3) |
11.某化学小组用下图装置电解CuCl2溶液制少量漂白液:
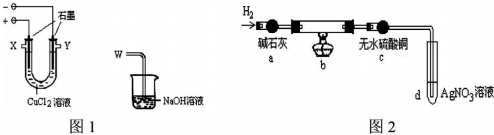
(1)图l阳极的反应式是:2Cl--2e-=Cl2↑,导气管W端应与出气口一X连接.
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质.某化学兴趣小组查阅资料可知:
化学小组分析提出:
①红色物质可能有Cu或Cu2O、或二者都有;
②白色物质为CuCl
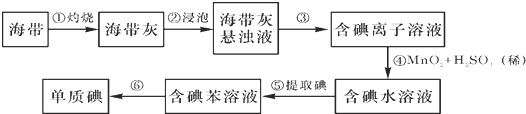
(3)为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:取出阴极碳棒,洗涤、干燥、称其质量为W1g,并将其放入图2所示装置b中,进行实验.实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g.
①碳棒上的红色物质是Cu,无水硫酸铜的作用是检验红色物质中有无Cu2O;
②d中反应的离子方程式是Ag++Cl-=AgCl↓;
③装置b中发生反应的化学方程式是2CuCl+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+2HCl.
④电解CuCl2溶液时,阴极上产生白色物质的原因用电极反应式解释为Cu2++e-+Cl-=CuCl↓.
⑤阴极上产生白色物质的物质的量是$\frac{{w}_{1}-{w}_{2}}{35.5}$mol;若装置b冷却时不继续通H2,则计算所得CuCl的产率会偏小(偏大、偏小、不变).

(1)图l阳极的反应式是:2Cl--2e-=Cl2↑,导气管W端应与出气口一X连接.
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质.某化学兴趣小组查阅资料可知:
| 物质名称及化学式 | 氯化亚铜CuCl | 碱式氯化铜Cu2(OH)3Cl |
| 性质 | 白色固体、不溶水 | 绿色固体、不溶水 |
①红色物质可能有Cu或Cu2O、或二者都有;
②白色物质为CuCl
(3)为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:取出阴极碳棒,洗涤、干燥、称其质量为W1g,并将其放入图2所示装置b中,进行实验.实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g.
①碳棒上的红色物质是Cu,无水硫酸铜的作用是检验红色物质中有无Cu2O;
②d中反应的离子方程式是Ag++Cl-=AgCl↓;
③装置b中发生反应的化学方程式是2CuCl+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+2HCl.
④电解CuCl2溶液时,阴极上产生白色物质的原因用电极反应式解释为Cu2++e-+Cl-=CuCl↓.
⑤阴极上产生白色物质的物质的量是$\frac{{w}_{1}-{w}_{2}}{35.5}$mol;若装置b冷却时不继续通H2,则计算所得CuCl的产率会偏小(偏大、偏小、不变).
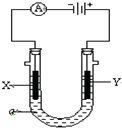 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: