题目内容
20.某硫酸钠溶液中含有6.02×1022个Na+,则该溶液中SO42-的物质的量是0.05mol.分析 根据n=$\frac{N}{{N}_{A}}$计算物质的量,结合硫酸钠的构成计算SO42-的物质的量.
解答 解:n(Na+)=$\frac{6.02×1{0}^{22}}{6.02×1{0}^{23}/mol}$=0.1mol,则n(SO42-)=$\frac{1}{2}$n(Na+)=0.05mol,
故答案为:0.05mol.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握物质的构成特点,难度不大.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
10.向c(H+)相等的一元酸HA和HB的溶液中分别加入适量的锌粉,充分反应后,当收集到的H2体积相等时,消耗酸的体积V(HA)>V(HB),下列分析正确的是( )
| A. | 消耗锌的质量m(HA)>m(HB) | B. | HA一定是强酸 | ||
| C. | 生成H2的平均反应速率v(HA)<v(HB) | D. | 酸性:HB>HA |
11.某化学小组用下图装置电解CuCl2溶液制少量漂白液:
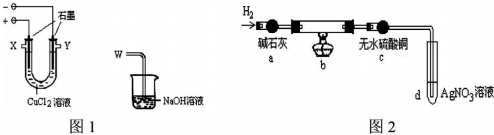
(1)图l阳极的反应式是:2Cl--2e-=Cl2↑,导气管W端应与出气口一X连接.
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质.某化学兴趣小组查阅资料可知:
化学小组分析提出:
①红色物质可能有Cu或Cu2O、或二者都有;
②白色物质为CuCl
(3)为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:取出阴极碳棒,洗涤、干燥、称其质量为W1g,并将其放入图2所示装置b中,进行实验.实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g.
①碳棒上的红色物质是Cu,无水硫酸铜的作用是检验红色物质中有无Cu2O;
②d中反应的离子方程式是Ag++Cl-=AgCl↓;
③装置b中发生反应的化学方程式是2CuCl+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+2HCl.
④电解CuCl2溶液时,阴极上产生白色物质的原因用电极反应式解释为Cu2++e-+Cl-=CuCl↓.
⑤阴极上产生白色物质的物质的量是$\frac{{w}_{1}-{w}_{2}}{35.5}$mol;若装置b冷却时不继续通H2,则计算所得CuCl的产率会偏小(偏大、偏小、不变).

(1)图l阳极的反应式是:2Cl--2e-=Cl2↑,导气管W端应与出气口一X连接.
(2)实验后发现阴极碳棒上除了附着有红色物质,还附着有少量白色物质.某化学兴趣小组查阅资料可知:
| 物质名称及化学式 | 氯化亚铜CuCl | 碱式氯化铜Cu2(OH)3Cl |
| 性质 | 白色固体、不溶水 | 绿色固体、不溶水 |
①红色物质可能有Cu或Cu2O、或二者都有;
②白色物质为CuCl
(3)为探究阴极碳棒上附着的红色、白色物质,设计了如下实验:取出阴极碳棒,洗涤、干燥、称其质量为W1g,并将其放入图2所示装置b中,进行实验.实验中,碳棒上的白色物质完全变为红色,无水硫酸铜不变色,d中出现白色沉淀;实验结束时,继续通H2直至碳棒冷却后,称量其质量为W2g.
①碳棒上的红色物质是Cu,无水硫酸铜的作用是检验红色物质中有无Cu2O;
②d中反应的离子方程式是Ag++Cl-=AgCl↓;
③装置b中发生反应的化学方程式是2CuCl+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+2HCl.
④电解CuCl2溶液时,阴极上产生白色物质的原因用电极反应式解释为Cu2++e-+Cl-=CuCl↓.
⑤阴极上产生白色物质的物质的量是$\frac{{w}_{1}-{w}_{2}}{35.5}$mol;若装置b冷却时不继续通H2,则计算所得CuCl的产率会偏小(偏大、偏小、不变).
5.一定条件下反应2A(g)?2B(g)+C(g)△H>0达平衡后,要增大逆反应速率而使C的浓度减小,可采取的措施是( )
| A. | 加压 | B. | 增加C的浓度 | C. | 增加B的浓度 | D. | 加热 |
9.NA表示阿伏加德罗常数,下列判断正确的是( )
| A. | 在16 g18O2中含有NA个氧原子 | |
| B. | 16 g CH4中含有4NA个C-H键 | |
| C. | 1 mol Cu和足量稀硝酸反应产生NA个NO分子 | |
| D. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol•L-1 |
10.下列说法正确的是( )
| A. | 如果5.6LN2含有n个氮分子,则NA一定约为4n | |
| B. | 18g水中所含的电子数是8NA | |
| C. | 在100mL0.5mol/L盐酸溶液中含有氯化氢分子数为0.05 NA | |
| D. | 23g Na+含有10mol电子 |
 甲醇是一种新型的能源.
甲醇是一种新型的能源.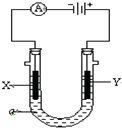 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: