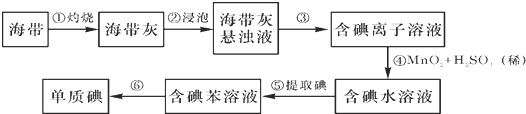
题目内容
5.下表是元素周期表的一部分,表中所列的字母分别代表某一种化学元素.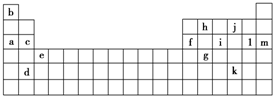
(1)上述第三周期元素中第一电离能(I1)最大的是m(用字母表示,下同),c和f的I1大小关系是c大于f.
(2)上述元素中,原子中未成对电子数最多的是i,写出该元素的电子排布式:1s22s22p63s23p3.
(3)根据下表所提供的电离能数据,回答下列问题.
| 锂 | X | Y | |
| I1 | 519 | 502 | 580 |
| I2 | 7296 | 4570 | 1820 |
| I3 | 11799 | 6920 | 2750 |
| I4 | 9550 | 11600 |
②Y是周期表中的ⅢA族的元素.
分析 由元素在周期表中位置,可知a为Na、b为H、c为Mg、d为Sr、e为Sc、f为Al、g为Ge、h为C、i为P、j为O、k为Te、l为Cl、m为Ar.
(1)其中Na、Mg、Al、P、Cl、Ar属于第三周期,原子最稳定的是Ar,故其I1最大,Mg中3s2为全满状态,第一电离能高于Al;
(2)i元素最外层电子排布为3s23p3,有3个未成对电子,未成对电子最多;
(3)由表中数据可以看出,锂和X的I1均比I2、I3小很多,说明X与Li同主族,且X的I1比Li的I1更小,说明X的金属性比锂更强,则X为Na;由Y的电离能数据可以看出,它的I1、I2、I3比I4小得多,故Y原子属于ⅢA族元素.
解答 解:由元素在周期表中位置,可知a为Na、b为H、c为Mg、d为Sr、e为Sc、f为Al、g为Ge、h为C、i为P、j为O、k为Te、l为Cl、m为Ar.
(1)其中Na、Mg、Al、P、Cl、Ar属于第三周期,原子最稳定的是Ar,故其I1最大,Mg、Al的核外电子排布分别为1s22s22p63s2、1s22s22p63s23p1,Mg中3s2为全满状态,故其I1比Al的I1大,
故答案为:m;c,f;
(2)i元素最外层电子排布为3s23p3,有3个未成对电子,未成对电子最多,核外电子排布式为1s22s22p63s23p3,
故答案为:i;1s22s22p63s23p3;
(3)①由表中数据可以看出,锂和X的I1均比I2、I3小很多,说明X与Li同主族,且X的I1比Li的I1更小,说明X的金属性比锂更强,则X为Na,X和j形成的化合物的化学式为Na2O、Na2O2,
故答案为:a;Na2O、Na2O2;
②由Y的电离能数据可以看出,它的I1、I2、I3比I4小得多,故Y原子属于ⅢA族元素,
故答案为:ⅢA.
点评 本题考查元素周期表与元素周期律综合应用,注意理解主族元素电离能与最外层电子数关系.

 全能测控一本好卷系列答案
全能测控一本好卷系列答案| A. | Z为0.3 mol•L-1 | B. | X2为0.2 mol•L-1 | ||
| C. | Y2为0.4 mol•L-1 | D. | c(X2)+c(Y2)+c(Z)=0.55 mol•L-1 |
| A. | 对溶液所在体系加热,溶液蓝色加深 | |
| B. | 对溶液所在体系用冰水降温,上述反应的平衡常数减小 | |
| C. | 室温下,加水稀释至一定范围,溶液为蓝色 | |
| D. | 室温下,加水稀释至一定范围,溶液为粉红色 |
| A. | 消耗锌的质量m(HA)>m(HB) | B. | HA一定是强酸 | ||
| C. | 生成H2的平均反应速率v(HA)<v(HB) | D. | 酸性:HB>HA |
| A. | 0.01mol | B. | 0.03mol | C. | 0.04mol | D. | 0.01~0.03mol |
 ,高温下灼烧该化合物火焰呈黄色.
,高温下灼烧该化合物火焰呈黄色.