题目内容
20.下列物质分别与NaOH的醇溶液共热后,能发生消去反应,且生成的有机物不存在同分异构体的是( )| A. | 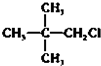 | B. |  | C. | CH3Cl | D. | 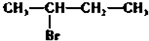 |
分析 卤代烃能发生消去反应的结构特点:与-X相连碳相邻碳上有氢原子才能发生消去反应,形成不饱和键;
分子中含有卤素原子、酯基等官能团的有机物能够发生水解反应.
解答 解:A. 分子中与-Cl相连碳的相邻碳上没有氢原子,不能发生消去反应,故A错误;
分子中与-Cl相连碳的相邻碳上没有氢原子,不能发生消去反应,故A错误;
B.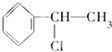 分子中能发生消去反应,且生成的烯烃只有一种,故B正确;
分子中能发生消去反应,且生成的烯烃只有一种,故B正确;
C.CH3Cl分子中只含有1个C,不能发生消去反应,故C错误;
D.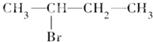 分子能够发生消去反应生成两种烯烃,故D错误;
分子能够发生消去反应生成两种烯烃,故D错误;
故选B.
点评 本题考查卤代烃发生消去反应的特点,题目难度不大,注意掌握消去反应、水解反应的概念及判断方法,明确反应的原理是解题的关键.

练习册系列答案
相关题目
11.L、M、R、T、W是原子序数依次增大的短周期主族元素,M、T在周期表中的相对位置如表:L与R原子的最外层电子数相同,R的单质是一种常见的半导体材料.请回答下列问题:
(1)T原子的结构示意图为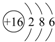 ,元素W在周期表中位于第三周期第ⅦA族,M单质分子的电子式为
,元素W在周期表中位于第三周期第ⅦA族,M单质分子的电子式为 .
.
(2)R是组成玻璃的元素之一,不能用带磨口玻璃塞的试剂瓶放氢氧化钠溶液的原因是(用化学方程式表示)SiO2+2NaOH═Na2SiO3+H2O.
(3)下列有关相应元素非金属性强弱比较的说法,正确的是(填序号)acd.
a.M的气态氢化物比R的气态氢化物稳定,则非金属性M强于R
b.高温下L的单质能从R的最高价氧化物中置换出R,则非金属性L强于R
c.W的核电荷数比T多,原子半径比T小,得电子能力强,则非金属性W强于T
d.同温、同物质的量浓度的Na2LO3和Na2TO4溶液pH:Na2LO3>Na2TO4,则非金属性T强于L
(4)工业上可用二氧化硅、氯气和焦炭在高温条件下制备RW4,该反应中除RW4外的另一种产物可以用于工业冶炼铁.制备RW4反应的化学方程式为2Cl2+SiO2+2C$\frac{\underline{\;高温\;}}{\;}$SiCl4+2CO.
| M | |
| T |
 ,元素W在周期表中位于第三周期第ⅦA族,M单质分子的电子式为
,元素W在周期表中位于第三周期第ⅦA族,M单质分子的电子式为 .
.(2)R是组成玻璃的元素之一,不能用带磨口玻璃塞的试剂瓶放氢氧化钠溶液的原因是(用化学方程式表示)SiO2+2NaOH═Na2SiO3+H2O.
(3)下列有关相应元素非金属性强弱比较的说法,正确的是(填序号)acd.
a.M的气态氢化物比R的气态氢化物稳定,则非金属性M强于R
b.高温下L的单质能从R的最高价氧化物中置换出R,则非金属性L强于R
c.W的核电荷数比T多,原子半径比T小,得电子能力强,则非金属性W强于T
d.同温、同物质的量浓度的Na2LO3和Na2TO4溶液pH:Na2LO3>Na2TO4,则非金属性T强于L
(4)工业上可用二氧化硅、氯气和焦炭在高温条件下制备RW4,该反应中除RW4外的另一种产物可以用于工业冶炼铁.制备RW4反应的化学方程式为2Cl2+SiO2+2C$\frac{\underline{\;高温\;}}{\;}$SiCl4+2CO.
5.下列各项表达中正确的是( )
| A. | Na2O2的电子式为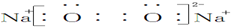 | B. | H2S2的结构式:H-S-S-H | ||
| C. | 原子核内有8个中子的碳原子148C | D. | NH4Cl的电子式: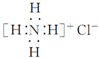 |
12.下列说法中正确的是( )
| A. | 元素性质的周期性变化是指原子半径、元素的主要化合价及原子核外电子排布的周期性变化 | |
| B. | 元素性质的周期性变化决定于元素原子结构的周期性变化 | |
| C. | 从Li→F,Na→Cl,元素的最高化合价均呈现从+1价→+7价的变化 | |
| D. | 电子总是尽量先排在能量较低的电子层,如排满了K层排L层,排满了M层排N层 |
9.将CH4跟Cl2混合,日光漫射,假设生成的4种氯代物的物质的量相等,则混合气体中CH4跟Cl2的物质的量比为( )
| A. | 1:4 | B. | 2:3 | C. | 1:7 | D. | 2:5 |
10.向c(H+)相等的一元酸HA和HB的溶液中分别加入适量的锌粉,充分反应后,当收集到的H2体积相等时,消耗酸的体积V(HA)>V(HB),下列分析正确的是( )
| A. | 消耗锌的质量m(HA)>m(HB) | B. | HA一定是强酸 | ||
| C. | 生成H2的平均反应速率v(HA)<v(HB) | D. | 酸性:HB>HA |
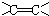 碳碳双键
碳碳双键  羰基
羰基 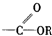 酯基.
酯基.
 ,高温下灼烧该化合物火焰呈黄色.
,高温下灼烧该化合物火焰呈黄色.