题目内容
15.工业生产水煤气的反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.4kJ•mol-1,下列判断正确的是( )| A. | 反应物能量总和大于生成物能量总和 | |
| B. | CO(g)+H2(g)?C(s)+H2O(l)△H=-131.4kJ•mol-1 | |
| C. | 水煤气反应中生成1molH2(g)吸收131.4 kJ热量 | |
| D. | 水煤气反应中生成1L CO(g)吸收131.4 kJ热量 |
分析 A、反应是吸热反应,依据能量守恒分析判断;
B、液态水转变成气态水要吸热;
C、依据反应焓变意义和热化学方程式计算;
D、1LCO的物质的量不是1mol.
解答 解:A、该反应是吸热反应,故反应物的总能量小于生成物的总能量,故A错误;
B、液态水转变成气态水要吸热,所以CO(g)+H2(g)=C(s)+H2O(l)放出的热量大于131.4 kJ,故B错误;
C、由题干反应可知生成1mol氢气吸收的热量为131.4 KJ,故C正确;
D、由题干反应可知生成1molCO吸收的热量为131.4 KJ,而1LC0物质的量不是1mol,故D错误;
故选C.
点评 本题考查了反应热量变化的判断,热化学方程式的计算应用,能量守恒的分析判断,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列各项表达中正确的是( )
| A. | Na2O2的电子式为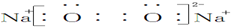 | B. | H2S2的结构式:H-S-S-H | ||
| C. | 原子核内有8个中子的碳原子148C | D. | NH4Cl的电子式: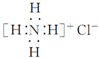 |
3.下表是元素周期表的一部分,下列有关说法中正确的是( )
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | c | d | f | ||||
| 3 | a | b | e |
| A. | e的氢化物比d的氢化物稳定 | |
| B. | a~f六种元素中,相互之间最易形成离子键的是a和f | |
| C. | a~f六种元素中,原子半径最大的是e | |
| D. | 由a、d两种元素形成的离子化合物中,不可能含有共价键 |
10.向c(H+)相等的一元酸HA和HB的溶液中分别加入适量的锌粉,充分反应后,当收集到的H2体积相等时,消耗酸的体积V(HA)>V(HB),下列分析正确的是( )
| A. | 消耗锌的质量m(HA)>m(HB) | B. | HA一定是强酸 | ||
| C. | 生成H2的平均反应速率v(HA)<v(HB) | D. | 酸性:HB>HA |
7.一定温度下,在体积可变的恒温密闭容器中,甲醇在浓硫酸作催化剂的条件下发生下列反应:2CH3OH(g)=CH3OCH3(g)+H2O(g)△H=-25kJ•mol-1,下列有关该反应的叙述正确的是( )
| A. | 该条件下,1 mol CH3OH(g)参加反应,放出的热量为25 kJ | |
| B. | 若不采用合适的催化剂,该反应中甲醇的转化率将降低 | |
| C. | 升高温度和增大压强(缩小容器容积)均可加快反应速率 | |
| D. | 反应过程中,2v(CH3OH)=v(CH3OCH3) |
4.下表各组物质中,物质之间不可能实现如图所示转化的是( )
[X]$\stackrel{M}{→}$[Y]$\stackrel{M}{→}$[Z]
[X]$\stackrel{M}{→}$[Y]$\stackrel{M}{→}$[Z]
| 选项 | X | Y | Z | M |
| A | Fe | FeCl2 | FeCl3 | Cl2 |
| B | Mg | C | CO | CO2 |
| C | NaOH | Na2CO3 | NaHCO3 | CO2 |
| D | NH3 | NO | NO | O 2 |
| A. | A | B. | B | C. | C | D. | D |
5.一定条件下反应2A(g)?2B(g)+C(g)△H>0达平衡后,要增大逆反应速率而使C的浓度减小,可采取的措施是( )
| A. | 加压 | B. | 增加C的浓度 | C. | 增加B的浓度 | D. | 加热 |