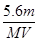题目内容
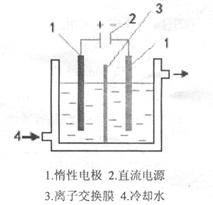
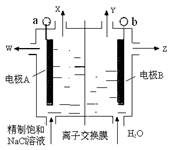
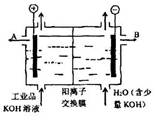
碘酸钾(KIO3)晶体是我国规定的食盐加碘剂。它通常是以碘为原料与过量KOH溶液通过下列反应制得:3I2+6KOH=5KI+KIO3+3H2O,再将KI和KIO3的混合溶液电解,将其中的I―转化为IO3―,装置如图。
(1)在反应3I2+6KOH=5KI+KIO3+3H2O中,氧化剂和还原剂的物质的量之比为 。
(2)电解前,将KI和KIO3混合溶液加入阳极区;将氢氧化钾溶液加入阴极区。电解槽用水冷却。电解时,阳极上的电极反应 ;阴极上得到的气体产物为 ;
(3)某同学查资料获知:KIO3在酸性介质中与碘化物作用生成单质碘,该反应的离子反应方程式为 ,为确定电解是否完成,需检验阳极区电解液中是否含有I―,该同学选用淀粉溶液和稀硫酸进行实验,其它仪器及用品自选,请完成其方案:
(4)电解完毕,从电解液中得到KIO3晶体的过程为:
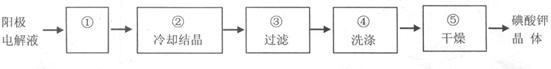
步骤①的操作名称 ,步骤④中洗涤晶体的目的 。

(1)在反应3I2+6KOH=5KI+KIO3+3H2O中,氧化剂和还原剂的物质的量之比为 。
(2)电解前,将KI和KIO3混合溶液加入阳极区;将氢氧化钾溶液加入阴极区。电解槽用水冷却。电解时,阳极上的电极反应 ;阴极上得到的气体产物为 ;
(3)某同学查资料获知:KIO3在酸性介质中与碘化物作用生成单质碘,该反应的离子反应方程式为 ,为确定电解是否完成,需检验阳极区电解液中是否含有I―,该同学选用淀粉溶液和稀硫酸进行实验,其它仪器及用品自选,请完成其方案:
| 实验操作 | 现象及结论 |
| | |
(4)电解完毕,从电解液中得到KIO3晶体的过程为:

步骤①的操作名称 ,步骤④中洗涤晶体的目的 。
(1)5:1
(2)I-+6OH--6e-=IO3-+3H2O 氢气
(3)IO3-+ 5I-+6H+=3I2+3H2O
【实验操作】取少量阳极区电解液于试管中,加稀硫酸酸化后,加入几滴淀粉 溶液,观察是否变蓝
【现象及结论】如果不变蓝,说明没有I-(如果变蓝,说明有I-)
(4)蒸发浓缩,洗去吸附在碘酸钾晶体表面的氢氧化钾等杂质
试题分析:(1)碘元素由0价升为+5价,则I2是还原剂,KIO3是氧化产物,碘元素还由0价降为—1价,则I2还是氧化剂,KI是还原产物;根据系数之比等于物质的量之比,由于氧化产物KIO3为1mol,则还原剂I2为1/2mol,还原产物KI为5mol,则氧化剂I2为5/2mol,所以该反应中氧化剂和还原剂的物质的量之比为5/2∶1/2=5∶1;(2)阳极发生氧化反应,根据题意可知其主要反应物和产物是I―→IO3―;碘元素由—1价升为+5价,根据化合价升高总数等于失去电子数可知,I―—6e―→IO3―;根据KOH溶液显碱性可知,应用OH―使左右电荷守恒,则I―—6e―+6OH―→IO3―;根据氢或氧原子个数守恒可知,I―—6e―+6OH―=IO3―+3H2O;溶液中的阳离子移向阴极,H+优先得到电子,发生还原反应,产生氢气,则阴极得到的气体产物是H2;(3)碘元素由+5价降为0价,说明KIO3是氧化剂,I2是还原产物,碘元素由—1价升为0价,说明I―是还原剂,I2还是氧化产物;根据化合价升降总数相等,则IO3―+5I―→3I2;酸性介质中可用H+使左右电荷守恒,则IO3―+5I―+6H+→3I2;根据氢或氧原子守恒可知,该反应为IO3―+5I―+6H+=3I2+3H2O;检验阳极区电解液中I―时,需要借助上述反应中碘离子的氧化产物(碘单质)遇淀粉变蓝的特性,就是要设法使碘离子转化为碘单质;因此实验时先取少量阳极区电解液于试管中,加稀硫酸酸化后,再加入几滴淀粉溶液,观察是否变蓝,若不变蓝,说明无碘离子;若变蓝,说明有碘离子;(4)根据混合物分离提纯的方法可知,从KIO3溶液中制KIO3晶体的过程分别为蒸发浓缩、冷却结晶、过滤、洗涤、干燥,则步骤①为蒸发浓缩;KIO3晶体上吸附着KOH等易溶性杂质,洗涤的目的是除去晶体表面吸附的易溶性杂质。

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
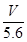 mol
mol