题目内容
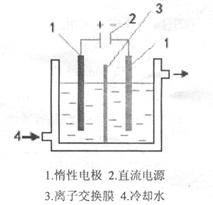
用石墨作电极,电解0.1 mol / L下列物质的溶液,溶液的pH值保持不变的是
| A.HCl | B.NaOH | C.Na2SO4 | D.KCl |
C
试题分析:根据溶液中离子的放电顺序判断溶液中氢离子浓度是否变化,从而确定溶液pH值是否变化。A、电解盐酸,溶液中氢离子、氯离子放电,所以溶液中氢离子浓度逐渐减小,pH值逐渐变大,故A错误;B、电解氢氧化钠溶液,溶液中氢离子、氢氧根离子放电,相当于电解水,导致溶液中氢氧化钠的浓度增大,溶液的pH值增大,故B错误;C、电解硫酸钠溶液,溶液中氢离子、氢氧根离子放电,相当于电解水,导致溶液中硫酸钠的浓度增大,但溶液中氢离子和氢氧根离子的浓度不变,仍然显中性,所以溶液的pH值保持不变,故C正确;D、电解氯化钠溶液,溶液中氢离子和氯离子放电,所以溶液中氢离子浓度逐渐减小,pH值逐渐变大,故D错误,答案选C。

练习册系列答案
相关题目
 Cu2O+H2↑下列说法正确的是
Cu2O+H2↑下列说法正确的是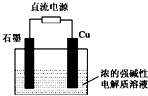

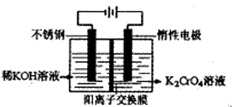
 2H2SO4+4NaOH+O2↑+2H2↑
2H2SO4+4NaOH+O2↑+2H2↑
 沉淀完全,而在pH≥3.2时
沉淀完全,而在pH≥3.2时
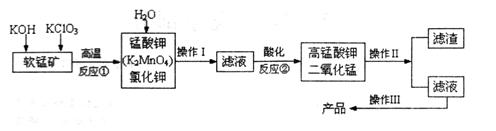
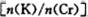 为d,则此时的铬酸钾的转化率为 。
为d,则此时的铬酸钾的转化率为 。