题目内容
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1molCu(OH) 2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为
| A.0.1mol | B.0.2mol | C.0.3mol | D.0.4mol |
D
试题分析:Cu(OH)2从组成上可看成CuO?H2O,加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH,即电解生成了0.1 mol H2SO4,并消耗0.1 mol H2O,由电解的总反应式为:
2H2O+2CuSO4
 2Cu+O2↑+2H2SO4 转移电子
2Cu+O2↑+2H2SO4 转移电子2mol 4mol
0.1mol 0.2mol
2H2O
 2H2↑+O2↑ 转移电子
2H2↑+O2↑ 转移电子2mol 4mol
0.1mol 0.2mol
所以电解过程中共转移电子为0.4 mol.
故选D。
点评:本题考查电解池的工作原理,电解池中有关电子转移数的计算技巧与能力,先根据原子守恒计算析出铜单质的物质的量,再根据铜与转移电子之间的关系计算转移电子的物质的量。难度稍难。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
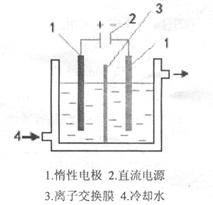
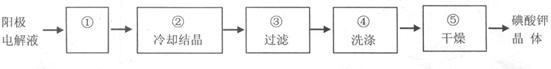
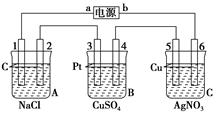
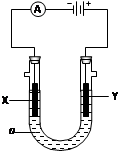
 2 L,原因是 。
2 L,原因是 。