题目内容
3.如图为番茄电池,下列说法正确的是( )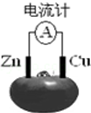
| A. | 锌电极为电池的正极 | |
| B. | 铜电极发生氧化反应 | |
| C. | 工作一段时间后,锌片质量会减轻 | |
| D. | 电池工作时,铜电极附近会出现蓝色 |
分析 根据金属的活泼性知,锌作负极,铜作正极,负极上锌失电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极,电流从正极沿导线流向负极.
解答 解:A、锌作该原电池的负极,故A错误;
B、铜作正极,正极上氢离子得电子发生还原反应,故B错误;
C、该原电池中,锌作负极,负极上锌失电子生成锌离子进入溶液,所以锌片的质量会变小,故C正确;
D、铜作正极,正极上氢离子得电子生成氢气,所以铜电极附近不会出现蓝色,故D错误;
故选C.
点评 本题考查了原电池原理,难度不大,明确溶液中阴阳离子的移动方向、电极的判断来解答.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
19.室温下,下列溶液中粒子浓度关系正确的是( )
| A. | 0.01mol•L-1H2S溶液:c(H+)>c(HS-)>c(S2-)>c(H2S)>c(OH-) | |
| B. | 0.1 mol•L-1NaHSO3溶液:c(Na+)+c(H+)<c(HSO3-)+c(SO32-)+c(OH-) | |
| C. | 等物质的量的NH4Cl和NaCl的混合溶液:c(NH4+)+c(NH3•H2O)+c(Na+)=2c(Cl-) | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的Na2CO3溶液:c(HCO3-)+c(H2CO3)=c(10-2-10-12) mol•L-1 |
14.下列说法正确的是( )
| A. | 相对分子质量相近的醇比烷烃沸点高是因为醇分子间存在氢键 | |
| B. | 苯和乙醇均不能使酸性高锰酸钾溶液褪色 | |
| C. | 红外光谱分析不能区分乙醇和乙酸乙酯 | |
| D. | 蛋白质、纤维素、蔗糖、淀粉都是高分子化合物 |
8.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子半径 A>B>D>C | B. | 原子序数 d>c>b>a | ||
| C. | 离子半径 C>D>B>A | D. | 元素的电负性 C>D>A>B |
15.某主族元素最外层只有1个电子,则该元素一定是( )
| A. | ⅠA族元素 | B. | +7价元素 | C. | 三周期元素 | D. | 金属元素 |
12.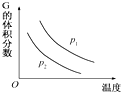 在一密闭容器中有如下反应:L(s)+aG(g)═bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )
在一密闭容器中有如下反应:L(s)+aG(g)═bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )
 在一密闭容器中有如下反应:L(s)+aG(g)═bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )
在一密闭容器中有如下反应:L(s)+aG(g)═bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )| A. | 正反应为放热反应 | B. | 化学方程式中的计量数a>b | ||
| C. | G的转化率随温度升高而减小 | D. | 增大压强,容器内气体的质量变大 |
13.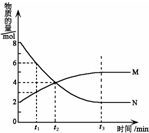 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图所示.下列叙述中,正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图所示.下列叙述中,正确的是( )
 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图所示.下列叙述中,正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图所示.下列叙述中,正确的是( )| A. | 该反应的化学方程式为2 M?N | |
| B. | t1时N的浓度是M浓度的2倍 | |
| C. | t2时正逆反应速率相等,反应达到平衡状态 | |
| D. | t3时正反应速率大于逆反应速率 |

