题目内容
8.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )| A. | 原子半径 A>B>D>C | B. | 原子序数 d>c>b>a | ||
| C. | 离子半径 C>D>B>A | D. | 元素的电负性 C>D>A>B |
分析 短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,由于原子形成阳离子失去一个电子层,原子形成阴离子电子层不变,故A、B处于第三周期,C、D处于第二周期,结合电荷可推知A为Mg、B为Na、C为N、D为F.
A.同周期自左而右原子半径减小、同主族自上而下原子半径增大;
B.核外电子数相等,则a-2=b-1=c+3=d+1,据此判断原子序数;
C.电子层结构相同,核电荷数越大离子半径越小;
D.同周期自左而右电负性增大、同主族自上而下电负性减小.
解答 解:短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,由于原子形成阳离子失去一个电子层,原子形成阴离子电子层不变,故A、B处于第三周期,C、D处于第二周期,结合电荷可推知A为Mg、B为Na、C为N、D为F.
A.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:Na>Mg>N>F,故A错误;
B.核外电子数相等,则a-2=b-1=c+3=d+1,故原子序数:a>b>d>c,故B错误;
C.核电荷数:A>B>D>C,电子层结构相同,核电荷数越大离子半径越小,故离子半径:C>D>B>A,故C正确;
D.同周期自左而右电负性增大、同主族自上而下电负性减小,故电负性:F>N>Mg>Na,故D错误,
故选C.
点评 本题考查位置结构性质的相互关系及应用,根据核外电子排布确定元素所在周期表中的位置,清楚元素周期律的递变规律是解答该题的关键,难度不大.

练习册系列答案
相关题目
19.当前在人类已知的化合物中,品种最多的是( )
| A. | ⅤA 族元素的化合物 | B. | ⅢB族元素的化合物 | ||
| C. | 过渡元素的化合物 | D. | ⅣA 族元素的化合物 |
16.在下列有关晶体的叙述中错误的是( )
| A. | 离子晶体中,一定不存在共价键 | B. | 原子晶体中,只存在共价键 | ||
| C. | 金属晶体的熔沸点均很高 | D. | 稀有气体的原子能形成分子晶体 |
3.如图为番茄电池,下列说法正确的是( )
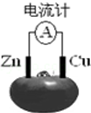

| A. | 锌电极为电池的正极 | |
| B. | 铜电极发生氧化反应 | |
| C. | 工作一段时间后,锌片质量会减轻 | |
| D. | 电池工作时,铜电极附近会出现蓝色 |
17.对于NaHCO3与Na2CO3的性质,下列叙述错误的是( )
| A. | 质量相同时,跟足量的盐酸反应,在相同条件下Na2CO3产生的CO2气体多 | |
| B. | 物质的量相同时,跟足量的盐酸反应,Na2CO3所消耗H+的物质的量是NaHCO3的2倍 | |
| C. | 物质的量相同时,跟足量的盐酸反应,在相同条件下得到等体积的CO2 | |
| D. | 将它们分别加入到澄清石灰水中,都产生白色沉淀 |
18.下列有关化学反应速率和限度的说法中,不正确的是( )
| A. | 实验室用H2O2制取O2,加入MnO2后,反应速率明显加快 | |
| B. | 在金属钠与足量水的反应中,增加水的量能加快反应速率 | |
| C. | 对于可逆反应来说,可以通过改变条件改变反应进行的限度 | |
| D. | 当一个可逆反应达到平衡状态时,就是该反应在该条件下所能达到的限度 |

 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.